Síntese de derivados pirimidínicos contendo o grupo ferrocenila com potencial atividade antineoplásica via reação de Biginelli modificada por Atwal
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Venturini Filho, E. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Brito, A.F. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Loureiro, L.B. (UNIVERSIDADE ESTADUAL DE CAMPINAS) ; Greco, S.J. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO)
Resumo
O núcleo pirimidínico e ferrocenila são exemplos de grupos com comprovada atividade anticâncer, e por isso, é de interesse da química sintética medicinal a síntese de novos híbridos moleculares que contenham ambos os núcleos, com finalidade de aumentar a eficácia dos tratamentos e diminuir o desenvolvimento de resistência nas células tumorais. 1–3 Para tal, nesse trabalho foi utilizada a metodologia de Claisen-Schimidt para a síntese das chalconas precursoras e a reação de Biginelli modificada por Atwal para obtenção das pirimidinas de interesse. As moléculas sintetizadas foram caracterizadas por espectroscopia no infravermelho e ressonância magnética nuclear de 1H.
Palavras chaves
Pirimidinas; Atividade Anticâncer; Ferroceno
Introdução
Câncer, ou neoplasma maligno, caracteriza-se pelo crescimento desordenado de células, causando diversos prejuízos ao organismo. A ocorrência da doença está crescendo rapidamente, com mais de 20 milhões de casos para 2025, sendo que no Brasil estima-se mais de meio milhão de novos casos para este ano. A alta taxa de mortalidade e severidade do tratamento fazem com que melhores formas de remediar a doença estejam sempre em desenvolvimento. 4–6 O combate às células doentes é feito através de radiação (radioterapia) e/ou compostos químicos (quimioterapia) através de fármacos. Porém a efetividade destes fármacos está abaixo do desejável, mesmo com o grande número de medicamentos, pois as células cancerígenas desenvolvem resistência ao medicamento usado. Por isso, a síntese de novas moléculas com potencial atividade antineoplásica é uma área de grande interesse na química sintética medicinal. 7 Um dos núcleos farmacofóricos de elevado interesse sintético é a pirimidina, que semelhantemente ao benzeno é um composto orgânico aromático, porém seu anel é heterocíclico, com átomos de nitrogênio nas posições 1 e 3. A atividade desses derivados é potencializada pela presença natural em muitos compostos importantes, tais como o sistema redox NADP/NADPH; maioria das vitaminas e ainda em ácidos nucleicos, onde são encontradas nas bases nitrogenadas componentes essenciais do DNA e RNA. 8–14 O núcleo pirimidínico pode ser obtido a partir de uma chalcona, uma cetona α,β-insaturada com dois substituintes aromáticos, um em cada extremidade desse sistema, formando uma longa cadeia conjugada. Algumas pirimidinas sintetizadas por nosso grupo de pesquisa (Figura 1) foram testadas quanto a sua potencial aplicação na inibição de enzimas participantes de vias de sinalização superexpressas em cânceres através de estudos computacionais de ancoragem molecular. Além disso, mostraram interessante atividade antitumoral através de estudos biológicos in vitro utilizando uma linhagem de melanoma metastático humano (SKMEL-103). 15 Em busca de intensificar o poderio antineoplásico das pirimidinas avalia-se a inserção do ferroceno. Um composto organometálico formado de dois ânions ciclopentadienil coordenados, um de cada lado, ao íon Fe2+, que também apresenta atividade anticâncer baseada na capacidade de formar espécies reativas de oxigênio (ROS), geradas a partir do equilíbrio Fe2+/Fe3+ existente no meio celular. 16–20 Deste modo, este trabalho propõe uma rota eficiente para síntese de pirimidinas contendo grupo ferrocenila 1 e 2 (Figura 1) vislumbrando combinar ambas estruturas supracitadas com potencial atividade anticâncer, num híbrido molecular a fim de que esses sejam mais potentes e seletivos.
Material e métodos
As chalconas precursoras 3 e 4 foram sintetizadas via condensação clássica de Claisen-Schimidt enquanto que as pirimidinas 1 e 2 foram preparadas através da reação de Biginelli modificada por Atwal. O curso reacional foi acompanhado por cromatografia em camada fina (CCF) utilizando cromatofolhas de alumínio recobertas com sílica gel UV254 (250 µm, 20x20 cm) e sua revelação foi efetuada por exposição à luz ultravioleta (250 e 300 nm). A pureza dos compostos sintetizados foi verificada através de ponto de fusão e as análises de espectroscopia no infravermelho foram realizadas utilizando o espectrômetro Perkin Elmer Spectrum 400. Todas as análises foram feitas utilizando o modo de Reflectância Total Atenuada (Attenuated total reflection - ATR) com cristal horizontal de seleneto de zinco (ZnSe), leituras de 16 scans e resolução de 4 cm-1 e janela espectral no infravermelho médio, região entre 4000 a 650 cm-1. As análises de espectroscopia de ressonância magnética nuclear de 1H foram realizadas utilizando o espectrômetro Varian 400MHz e sonda de 5 mm Broadband 1H/X/D. Os deslocamentos químicos (δ) estão relatados em ppm em relação a um padrão interno e foi utilizado CDCl3 como solvente. Para obtenção das chalconas precursoras 3 e 4 foi utilizado um balão de fundo redondo de 10 mL onde foram adicionados 4,0 mL de metanol, 1,5 mmol de NaOH, 1 mmol do ferrocenocarboxaldeído e 1 mmol da respectiva cetona enolizável (acetofenona e p-nitroacetofenona, respectivamente). 21 O término da reação foi verificado por CCF. A mistura reacional foi vertida em béquer contendo água e gelo e os sólidos formados, laranja para 1 (P.f.= 131 °C) e roxo para 2 (P.f.= 220 °C) foram filtrados à vácuo e lavado abundantemente com água gelada. Para a síntese das pirimidinas 1 e 2 foram adicionados 1 mmol das chalconas precursoras 3 e 4, 1,5 mmol de hidrocloreto de guanidíneo em balão de fundo redondo e 10 mL contendo 5,0 mL de etanol e 4,5 mmol de NaOH. A temperatura foi mantida em 30ºC. O isolamento da reação, após verificação do seu término por CCF, se deu por filtração do precipitado formado após resfriamento da mistura reacional seguido de filtração a vácuo. Os precipitados, vermelho para 1 (P.f. = 180-181 °C) e marrom para 2 (P.f. = 206-208 °C), foram lavados com água gelada.
Resultado e discussão
Recentemente foi sintetizado por nosso grupo de pesquisa duas novas
pirimidinas 5 e 6 substituídas em C2 por um grupamento amina, em C4 por um
grupo fenila p-substituído e em C6 por um grupo p-metoxifenil ou 2-fenil-2H-
1,2,3-triazol (Figura 2), a fim de avaliar o sinergismo dos núcleos
pirimidínico e 1,2,3-triazólico, ambos com potencial atividade anticâncer.
15
Estudos in vitro de MTT com as pirimidinas 5 e 6 foram realizados utilizando
uma linhagem celular tumoral humana: SKMEL-103 (melanoma metastático), que
possui alta agressividade e resistência a quimioterápicos convencionais. Ao
se analisar os resultados obtidos para cada uma das moléculas (Figura 3),
foi possível observar que a pirimidina 6 induziu uma diminuição da
viabilidade celular de SKMEL-103 com uma relação dose dependente, enquanto o
aumento da dosagem da pirimidina 5 não produziu efeitos significativos na
viabilidade celular da linhagem selecionada. Os valores de IC50 foram
determinados e para a pirimidina 5 foi igual a 140,2 μM enquanto que para a
pirimidina triazólica 6 foi de 34,33 μM. Além disso, foi evidenciado que
apenas a última apresentou toxicidade significativa na linhagem tumoral
estudada e que nenhuma das duas apresentou citotoxicidade frente a células
saudáveis. Estes resultados comprovam a ideia do sinergismo dos núcleos
pirimidínico e triazólico na atividade anticâncer, visto que a molécula que
continha os dois núcleos teve melhor desempenho, sendo quase três vezes mais
potente que a pirimidina 5.
Esses resultados nos encorajaram a desenvolver as duas novas pirimidinas 1 e
2, estruturalmente semelhantes a 5 e 6, porém, agora contendo o núcleo
ferrocenila no carbono C6 com o intuito de avaliar o efeito desse
organometálico, na atividade anticâncer desses compostos.
Para esse propósito, as chalconas 3 e 4 (Figura 1) foram sintetizadas
utilizando a metodologia clássica de condensação de Claisen-Schimidt, na
qual fez-se reagir uma cetona enolizável (acetofenona e p-nitroacetofenona),
na presença de hidróxido de sódio aquoso em metanol como solvente e do
respectivo aldeído não-enolizável (ferrocenocarboxaldeído). Os rendimentos
obtidos nessa etapa foram de 97% para 3 e 95% para 4.
A síntese das pirimidinas 1 e 2 mostrou-se desafiadora, visto que, a
reprodução de metodologias já reportadas na literatura se mostraram
infrutíferas. Inicialmente efetuou-se a reação segundo metodologia descrita
por Rashinkar e colaboradores onde foi empregado excesso de guanidina, NaOH
como base e refluxo. Nessas condições obteve-se uma mistura intratável de
produtos e rendimentos baixíssimos. 22 Posteriormente, fez-se a troca do
NaOH pelo terc-butóxido de potássio, mais volumoso, com propósito de tentar
minimizar possíveis subprodutos em um eventual ataque nucleofílico da base à
carbonila. No entanto, novamente foi obtido uma mistura complexa de produtos
em baixos rendimentos. 23 Em seguida, realizou-se o experimento nas
condições iniciais, meio básico com NaOH, sob refluxo, porém, com adições de
porções de peróxido de hidrogênio por 1h. 24 Mais uma vez verificou-se a
formação de subprodutos de difícil separação e rendimentos finais pouco
satisfatórios.
Baseado nestes resultados, estudos de variação da temperatura reacional
foram realizados, chegando na combinação de melhor custo-benefício, a saber:
etanol como solvente, excesso de hidrocloreto de guanidíneo, hidróxido de
sódio como base e aquecimento (30°C). O tempo reacional foi de 48h para 1 e
120h para 2. Para o isolamento da reação, fez-se uma filtração a vácuo do
produto bruto com subsequente lavagem do material com etanol gelado para
obter o produto puro. Esses ajustes metodológicos elevou os rendimentos das
pirimidinas 1 e 2, antes insignificantes, para 57% e 73%, respectivamente.
O mecanismo dessa reação se inicia pela adição conjugada da guanidina, na
chalcona, como sugerido por Atwal 25, no entanto, a guanidina utilizada na
forma de sal, cloridrato de guanidínio é uma espécie pouco nucleofílica
devido à carga positiva presente em um dos átomos de nitrogênio (Figura 4).
Para contornar este quadro, como ressaltado na metodologia, foi adicionado
excesso de hidróxido de sódio no meio a fim de gerar uma espécie
suficientemente nucleofílica. Posteriormente a adição 1,4 ocorre o ataque
nucleofílico do outro nitrogênio da guanidina à carbonila da chalcona,
formando o intermediário cíclico hidroxilado. Via assistência anquimérica do
par de elétrons não ligante do nitrogênio adjacente, a hidroxila é eliminada
facilitando a formação do intermediário diidropirimidinônico. Este
intermediário, entretanto, é facilmente oxidado em solução, levando a
formação das pirimidinas de interesse (Figura 3).
Os IV’s dos híbridos moleculares pirimidínicos 1 e 2 apresentaram as
seguintes bandas características: 1626 cm-1 e 1623 cm-1 atribuído ao ν(C=N)
do anel pirimidínico, 1570 cm-1 e 1572 cm-1, atribuído ao ν(C=C) aromático e
o ν(NH2) presente no espectro de 1 em 3450 e 3294 cm-1 e 2 em 3496 e 3313
cm-1. Além das bandas em 842/822 cm-1 γ(C-H) e 768/780 cm-1 γ(C=C),
atribuídas ao núcleo ferrocênico.
Adicionalmente, no espectro de RMN de 1H do composto 1 notou-se os sinais
característicos do grupo ferrocenila, em 4.10 (5H), 4.46 (2H) e 4.97 (2H)
ppm, enquanto que em 2 estes sinais foram observados com deslocamentos
químicos superiores: 4.16 (5H), 4.58 (2H) e 5.09 (2H) ppm, provavelmente
devido à presença do grupo nitro retirador de densidade eletrônica. Foram
observados multipletos em 7.48 (2H) e 8.02 (3H) ppm atribuídos aos
hidrogênios aromáticos proveniente da acetofenona em 1, e em 8.23 (2H) e
8.34 (2H) ppm da p-nitroacetofenona para o híbrido 2. Observou-se ainda o
singleto alargado característico de hidrogênios da amina para 1 e 2, em 5.10
(2H) e 5.67 (2H) ppm, respectivamente, que confirmam contundentemente a
formação da pirimidina. Finalmente, os singletos em 7.12 (1H) para 1 e 7.13
(1H) ppm para 2, foram atribuídos aos hidrogênios metínicos presente no anel
pirimidínico.
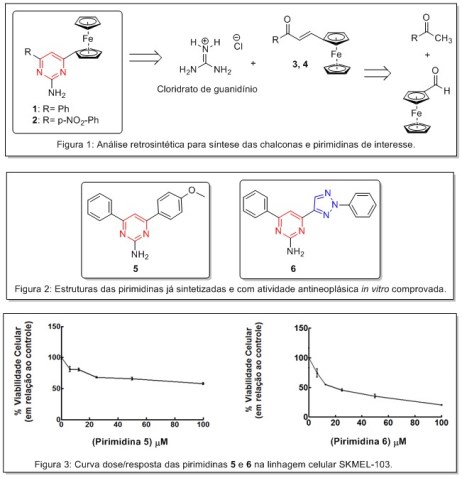
Análise retrosintética, Pirimidinas sintetizadas pelo LSOA com atividade in vitro comprovada e Curva dose/resposta das mesmas frente a SKMEL-103.
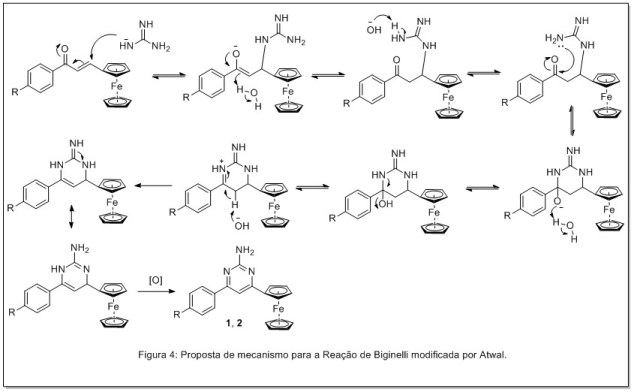
Proposta de mecanismo para reação de Biginelli modificada por Atwal.
Conclusões
Foram sintetizados neste trabalho as chalconas precursoras 3 e 4, via reação clássica de Claisen-Schmidt, obtendo rendimentos superiores a 95%. Posteriormente, foram obtidos os híbridos moleculares 1 e 2 derivados das chalconas ferrocênicas, com rendimentos de 57 e 73%, respectivamente, através da metodologia de Biginelli modificada por Atwal, em condições otimizadas nesse trabalho. As moléculas alvo foram caracterizadas por IV, onde pode-se observar as bandas referentes aos estiramentos característicos do heterociclo formado, além das bandas já presentes nos precursores que também foram identificadas. No RMN 1H foram atribuídos os sinais do núcleo ferrocênico e dos hidrogênios aromáticos esperados, fenil e p-NO2-fenil, e foi possível comprovar a formação da pirimidina através dos sinais referentes aos hidrogênios do grupo amina e metínico.
Agradecimentos
Pela estrutura e apoio técnico agradecemos a UFES, ao Laboratório de Síntese orgânica e Medicinal (LSOA) e ao NCQP/DQUI. E aos órgãos de fomento CNPq e FAPES.
Referências
1. Jain, K. S., Chitre, T. S., Miniyar, P. B., Kathiravan, M. K. & Bendre, V. S. Biological and medicinal significance of pyrimidines. Curr. Sci. 90, 793–803 (2006).
2. Taha, M. et al. Molecular hybridization conceded exceptionally potent quinolinyl- oxadiazole hybrids through phenyl linked thiosemicarbazide antileishmanial scaffolds : In silico validation and SAR studies. Bioorg. Chem. 71, 192–200 (2017).
3. Karthikeyan, C., Solomon, V. R., Lee, H. & Trivedi, P. Design, synthesis and biological evaluation of some isatin-linked chalcones as novel anti-breast cancer agents: A molecular hybridization approach. Biomed. Prev. Nutr. 3, 325–330 (2013).
4. O que é o câncer? INCA. http://www2.inca.gov.br/wps/wcm/connect/cancer/site/oquee 2–3 (2017).
5. Bednarz, H., Shaw, A., West, S. & Nair, D. R. The Biology of cancer. http://sphweb.bumc.bu.edu/otlt/mph-modules/ph/ph709_cancer/ph709_cancer_print.html (2016). Available at: http://www.news-medical.net/health/Cancer-History.aspx.
6. Estimativa 2016: incidência de câncer no Brasi. Inst. Nac. Câncer José Alencar Gomes da Silva. Coord. Prevenção e Vigilância (2015).
7. ScienceDirect. Pesquisa com as palavras ‘Bioactive heterocycles’ no portal de periódicos ScienceDirect. May http://www.sciencedirect.com (2017).
8. Sanchit, S., Kanishk, L., Chhama, S. & Rajender, Y. BIOLOGICALLY ACTIVE PYRIMIDINE HYDRAZONES. J. Drug Deliv. Ther. 5, 14–17 (2015).
9. Merugu, R., Garimella, S., Balla, D. & Sambaru, K. Synthesis and Biological Activities of Pyrimidines : A Review. Int. J. PharmTech Res. 8, 88–93 (2015).
10. Sathishaa, K. R., Gopal, S. & Rangappa, K. S. BIOLOGICAL ACTIVITIES OF SYNTHETIC PYRIMIDINE DERIVATIVES. World J. Pharm. Res. 5, 1467–1491 (2015).
11. Sahu, M. & Siddiqui, N. A REVIEW ON BIOLOGICAL IMPORTANCE OF PYRIMIDINES IN THE NEW ERA. Int. J. Pharm. Pharm. Sci. 8, 8–21 (2016).
12. Singh, R. & Chouhan, A. An overview of biological importance of pyrimidines. WORLD J. Pharm. Pharm. Sci. 3, 574–597 (2014).
13. Mohana, K. N., Prasanna Kumar, B. N. & Mallesha, L. Synthesis and biological activity of some pyrimidine derivatives. drug Invent. today 5, 216–222 (2013).
14. Patel, K. S., Raval, K. N., Patel, S. P., Patel, A. G. & Patel, S. V. A REVIEW ON SYNTHESIS AND BIOLOGICAL ACTIVITIES OF PYRIMIDINE DERIVATIVES. Int. J. Pharm. Biol. Sci. 2, 170–182 (2012).
15. Loureiro, L. B. Síntese, estudo de ancoragem molecular e avaliação da atividade anticâncer in vitro de novas 2-amino-4-fenil-6-(2-fenil-2H-1,2,3- triazol)pirimidinas. (2016).
16. Ornelas, C. Application of ferrocene and its derivatives in cancer research. New J. Chem. 35, 1973 (2011).
17. Allard, E. et al. Local delivery of ferrociphenol lipid nanocapsules followed by external radiotherapy as a synergistic treatment against intracranial 9L glioma xenograft. Pharm. Res. 27, 56–64 (2010).
18. Allard, E. et al. Lipid nanocapsules loaded with an organometallic tamoxifen derivative as a novel drug-carrier system for experimental malignant gliomas. J. Control. Release 130, 146–153 (2008).
19. Snegur, L. V. et al. Ferrocenylalkyl azoles: Bioactivity, synthesis, structure. Appl. Organomet. Chem. 22, 139–147 (2008).
20. Krishna, A. D. S., Panda, G. & Kondapi, A. K. Mechanism of action of ferrocene derivatives on the catalytic activity of topoisomerase II a and b —Distinct mode of action of two derivatives. Arch. Biochem. Biophys. 438, 206–216 (2005).
21. Suwito, H., Novi Kristanti, A. & Nyoman Tri Puspaningsih, N. Chalcones: Synthesis, structure diversity and pharmacological aspects. J. Chem. Pharm. Res. 6, 1076–1088 (2014).
22. Rashinkar, G. S., Pore, S. B., Mote, K. B. & Salunkhe, R. S. An efficient synthesis of novel 2-amino-4-aryl-6-ferrocenyl pyrimidines. Indian J. Chem. Sect. B-Organic Chem. Incl. Med. Chem. 48, 606–610 (2009).
23. Vyas, D. H., Tala, S. D., Akbari, J. D., Dhaduk, M. F. & Joshi, H. S. Synthesis and biological evaluation of some Aminopyrimidines and pyranones. Indian J. Heterocycl. Chem. 18, 187–188 (2008).
24. Antuf, A. D., Zhulanov, V. E., Dmitriev, M. B. & Mokrushin, I. G. New Nitrogen Heterocycles Containing a Ferrocene Fragment : Optical and Physicochemical Properties. 87, 470–478 (2017).
25. Atwal, K. S., Rovnyak, G. C., Reilly, B. C. O. & Schwartz, J. Substituted 1,4-Dihydropyrimidines. 3.’ Synthesis of Selectively Functionalized. J. Org. Chem. 54, 5898–5907 (1989).
































