Síntese Regioespecífica de Novos Tioéteres Derivados da Juglona
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Gomes, C.B.S.M.R. (UFF) ; da Rocha, D.R. (UFF) ; Cordeiro, P.S. (UFF) ; do Nascimento, V. (UFF)
Resumo
O objetivo deste trabalho consiste na síntese regioespecífica de novos tioéteres derivados da juglona. Sendo desenvolvida uma metodologia exclusiva para a obtenção dos compostos 8-hidroxi-2-(tio)naftaleno-1,4-diona e 5- hidroxi-2-(tio)naftaleno-1,4-diona, a partir da síntese regioespecífica de derivados clorados da juglona que posteriormente, sofrem uma reação de substituição utilizando diferentes dissulfetos, dando origem aos compostos desejados. Foram sintetizados 7 derivados do tipo 8-hidroxi-2- (tio)naftaleno-1,4-diona com rendimentos entre 30 e 95% e 7 derivados do tipo 5-hidroxi-2-(tio)naftaleno-1,4-diona com rendimentos entre 24 e 73%. Neste trabalho foram sintetizadas 14 tioéteres, sendo 12 inéditos. E os compostos estão sob avaliação das suas propriedades anticâncer.
Palavras chaves
Juglona; Tioéteres; Síntese Regioespecífica
Introdução
Pesquisas realizadas pela Organização Mundial de Saúde (OMS) em 2017, apresentam o câncer como uma das maiores causas de mortes no mundo, dados indicam que a cada ano 8,8 milhões de pessoas morrem de câncer, sendo que sua incidência continua a aumentar, principalmente em países de baixa e média renda. Embora muito conhecimento já tenha sido adquirido no entendimento do mecanismo de atuação de substâncias químicas que afetem o crescimento celular, e este conhecimento tenha sido usado no planejamento de novos compostos quimioterápicos, faz-se necessário o desenvolvimento de novos compostos mais ativos e, sobretudo seletivos. Neste aspecto, pode-se destacar a importante atividade citotóxica apresentada pelas quinonas, que representam uma ampla e variada família de metabólitos secundários de ocorrência natural. O interesse por estas substâncias foi intensificado nos últimos anos devido à sua vasta importância farmacológica, devendo-se destacar a capacidade que os compostos pertencentes a esta família apresentam de induzir apoptose celular, mais precisamente de células malignas (FERREIRA, et al., 2010). O presente projeto tem por objetivo a síntese regioespecífica de novos tioéteres derivados da juglona, uma naftoquinona natural, através da adição de tióis, visando sua avaliação biológica contra diversas células de diferentes linhagens de câncer.
Material e métodos
A determinação estrutural das substâncias sintetizadas foi realizada através dos métodos instrumentais de espectroscopia de Ressonância Magnética Nuclear de Hidrogênio (RMN de 1H) a 300 e 500 MHz e de carbono 13 (RMN de 13C) a 75 e 125 MHz, por Espectroscopia de Infravermelho (IV) e por espectroscopia de massas. Os espectros de RMN foram obtidos em aparelho Varian VNMRS 500 MHz ou Varian VNMRS 300 MHz e os deslocamentos químicos foram determinados utilizando-se TMS ou o solvente como referência interna. Os valores destes deslocamentos foram referidos em partes por milhão (ppm) em relação ao TMS e as constantes de acoplamento (J) em Hertz (Hz). As áreas dos sinais foram obtidas por integração eletrônica, suas multiplicidades descritas da seguinte forma: s-simpleto; d-dupleto; dd-duplodupleto; t-tripleto; m- multipleto. Os espectros na região do infravermelho foram obtidos em espectrofotômetro Perkin-Elmer, modelo 1420 de feixe duplo em feixe sobre janelas de NaCl. Os valores para as absorções foram expressos em número de onda, utilizando como unidade o centímetro recíproco (cm-1). Os pontos de fusão das substâncias foram determinados em aparelho de Fisher- Johns (Melting pointapparatus) série 50200082. Os espectros de massas foram realizados pela Fiocruz, em aparelho QTOF/Micro da Waters-Micromass. O processo de monitoramento das reações foi realizado através da cromatografia em camada fina (ccf), em cromatofolhas de sílica gel 60-F-254, com 0,2 mm de espessura (ref. Merck 5554). Os eluentes foram preparados volume a volume (v/v) e a visualização das substâncias em ccf foi realizada em lâmpada de ultravioleta (em 254 e 366 nm). Para purificação das substâncias por cromatografia em coluna foi utilizada gel de sílica 60 do tipo flash 230-400 Mesh ASTM (0,035-0,070 mm, ref. Acros Organics).
Resultado e discussão
Para a síntese regioespecífica a etapa decisiva é a cloração, que produz
exclusivamente os intermediários 3, através da obtenção da juglona
(2) em 85 % de rendimento (DA ROCHA, et al., 2011), a partir da oxidação
do 1,5-naftalenodiol (1) e 5, sintetizado a partir do 1,5-
diacetatonaftaleno (4) com 80% de rendimento (GRUNWELL, et al., 1991),
através da acetilação do 1,5-naftalenodiol (1) em 96 % de rendimento
(Esquema 1).
A inserção do cloro permite a realização de uma reação de substituição
nucleofílica nas posições C-2 e C-3 da juglona, a partir dos compostos
5 e 3 respectivamente, utilizando diferentes dissulfetos
(Esquema 2). Assim, utilizou-se o 3-cloro-juglona (3) para
produzir as 5-hidroxi-2-(tio)naftaleno-1,4-diona (6a-g) e a 2-cloro-
juglona (5) para produzir as 8-hidroxi-2-(tio)naftaleno-1,4-diona
(7a-g).
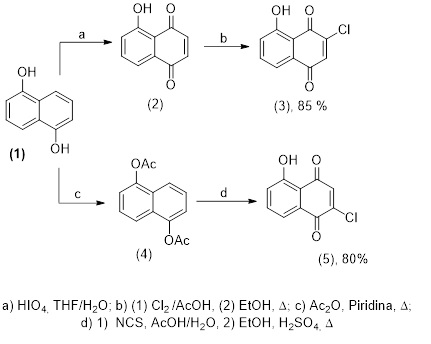
Síntese regioespecífica das cloro-juglonas (3) e (5)
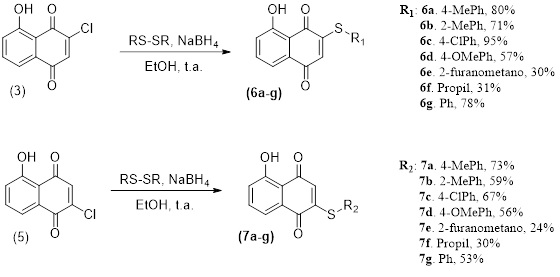
Síntese dos tioéteres 6 e 7
Conclusões
Neste trabalho foram sintetizadas 14 tioéteres, dos quais 12 são inéditos. A metodologia aqui empregada se mostrou muito superior à relatada previamente na literatura (DA ROCHA, et al., 2011), uma vez que permitiu a obtenção de tioéteres purificáveis empregando técnicas mais simples e em maiores rendimentos. Estes compostos estão sob avaliação das suas propriedades anticâncer, e uma vez que se têm estes resultados, será possível entender como grupos ligados ao núcleo de naftoquinona podem influenciar a sua atividade citotóxica de acordo com o seu perfil eletrônico. Todos os intermediários e produtos finais foram devidamente caracterizados por ressonância magnética nuclear de hidrogênio, carbono e infravermelho.
Agradecimentos
CAPES, CNPq, FAPERJ e FINEP.
Referências
DA ROCHA, D. R.; DE SOUZA, A. C. G.; RESENDE, J. A. L. C.; SANTOS, W. C.; DOS SANTOS, E. A.; PESSOA, C.; DE MORAES, M. O.; COSTA-LOTUFO, L. V.; MONTENEGRO, R. C.; FERREIRA, V. F. Synthesis of new 9-hydroxy-α- and 7-hydroxy-β-pyran naphthoquinones and cytotoxicity against cancer cell lines. Organic & Biomolecular Chemistry, 9, 4315-4322, 2011.
FERREIRA, S. B.; GONZAGA, D. T. G.; SANTOS, W. C.; ARAÚJO, K. G. L.; FERREIRA, V. F. b-Lapachona: Sua Importância em Química Medicinal e Modificações Estruturais. Revista Virtual de Química, v. 2, n. 2, p. 140-160, 2010.
GRUWELL, J. R.; KARIPIDES, A.; WIGAL, C. T.; HEIZMAN, S. W.; PARLOW, J.; SURSO, J. A.; CLAYTON, L.; FLEITZ, F. J.; DAFFNER, M.; STEVENS, J. E. The formal oxidative addition of electron-rich transoid dienes to bromonaphthoquinones. Journal of Organic Chemistry, 56, 91-95, 1991.
































