Síntese de Novas Isocumarinas, via acoplamento cruzado de Castro-Stephens, Visando suas Atividades Biológicas
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
da Silva Santos, L. (UFMG) ; Fillipe Langanke de Carvalho, M. (UFMG) ; Pereira de Freitas, R. (UFMG) ; Brondi Alves, R. (UFMG)
Resumo
Esse trabalho apresenta a síntese de novos compostos isocumarínicos de interesse farmacológico. Essas novas isocumarinas foram obtidas via acoplamento cruzado de Castro-Stephens entre o ácido 2-bromo-5-metoxibenzóico e alcinos derivados de alcóois benzílicos com bons rendimentos (73 a 78%).
Palavras chaves
isocumarina; castro-stephens; atividade biológica
Introdução
Isocumarinas são lactonas aromáticas de origem natural que apresentam grande interesse para os químicos sintéticos e medicinais. A importância das isocumarinas está relacionada não apenas a ocorrência natural desses compostos, mas também devido a suas diversificadas atividades biológicas[1]. Dentre estas destacam-se antifúngica[2], anti-inflamatória[3], antimicrobiana[4], antitumoral[5], antioxidante[6], entre outras. Esta ampla aplicação farmacológica é atribuída a variedade estrutural presente no esqueleto desses compostos[1]. Sendo assim, esse trabalho visa a obtenção de novos compostos isocumarínicos visando o potencial farmacológico desses.
Material e métodos
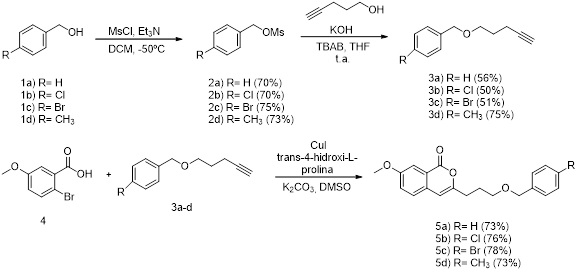
Em um balão de fundo redondo foram adicionados 10 mL de diclometano e 2 mmol do álcool de partida (1a-d). O sistema foi resfriado a -50ºC e em seguida, foram adicionados 1,08 mL (2,0 mmol) de trietilamina e 0,21 mL (1,4 mmol) de cloreto de mesila. A agitação foi mantida por 30 minutos a -50 ºC e ao término da reação foram adicionados 15 mL de água destilada e a fase orgânica foi recolhida e lavada com solução de HCl 1 mol/L, solução saturada de NaHCO3 e água destilada. Por fim, a fase orgânica foi secada com Na2SO4, o solvente eliminado sobre pressão reduzida e o produto foi obtido sem demais purificações[7]. A seguir, em um balão de fundo redondo, foram adicionados 2 mmol do benzil metanossulfonato (2a-d), 252 mg (3 mmol) do 4-pentin-1-ol, 74 mg (0,2 mmol) do TBAB e 171 mg (3 mmol) de KOH e 15 mL de THF. A agitação foi mantida por 24 horas e ao fim da reação foram adicionados 20 mL de água destilada e foi feita uma extração com diclorometano, a fase orgânica foi recolhida, secad a com Na2SO4 e o material obtido foi purificado em coluna cromatográfica[8]. Finalmente, em um balão de fundo redondo, foram adicionados 231 mg (1 mmol) do ácido 2-bromo-5-metoxibenzóico 4, 131 mg (0,2 mmol) da trans-4-hidroxi-L- prolina, 38 mg (0,2 mmol) de iodeto de cobre (I) e 276 mg (2 mmol) de carbonato de potássio. O sistema foi aquecido a 70º C, sob atmosfera de nitrogênio, e foram adicionados 1 mmol do alcino correspondente (3a-d). A mistura reacional foi agitada por uma noite e, após esse período, o sistema foi resfriado à temperatura ambiente e adicionaram-se 30 mL de acetato de etila. Foi adicionada água, recolheu-se a fase orgânica que foi secada com Na2SO4 e o solvente foi eliminado. O material obtido foi após purificação em coluna[9].
Resultado e discussão
Inicialmente, foram realizadas reações de mesilação com os álcoois benzílicos
1a-d e seus respetivos produtos mesilados 2a-d foram obtidos com bons
rendimentos (76 a 99%). Essa reação foi importante para tornar a hidroxila um
bom grupo abandonador. Então, a partir dos compostos 2a-d foram feitas reações
de substituição nucleofílica utilizando-se catálise de transferência de fase.
Essas reações levaram aos produtos 3a-d com rendimentos variáveis entre 50 e
75%. Por fim, foram obtidas as isocumarinas via reação de acoplamento cruzado
de Castro-Stephens conduzindo aos produtos lactônicos com rendimentos entre 73
e 78%.
Conclusões
Essa síntese mostrou-se eficiente para a obtenção de derivados isocumarínicos com bons rendimentos. Tais compostos apresentam grande interesse devido a sua grande variedade de atividades biológicas que apresentam que serão testados em breve.
Agradecimentos
Aos órgãos de fomento Capes, Fapemig e CNPq pelo financiamento da pesquisa.
Referências
1) Pal, S.; Chatare, V.; Pal, M., Isocoumarin and Its Derivatives: An Overview on their Synthesis and Applications. Curr Org Chem 2011, 15, 782-800.
2) Simic, M.; Paunovic, N.; Boric, I.; Randjelovic, J.; Vojnovic, S.; Nikodinovic-Runic, J.; Pekmezovic, M.; Savic, V., Functionalised isocoumarins as antifungal compounds: Synthesis and biological studies. Bioorganic & Medicinal Chemistry Letters 2016, 26 (1), 235-239.
3) Furuta, T.; Fukuyama, Y.; Asakawa, Y. Polygonolide an Isocoumarin from Polygonum-Hydropiper Possessing Anti-Inflammatory Activity. Phytochemistry, 1986, 25, 517-520.
4) Endringer, D. C.; Guimares, K. G.; Kondratyuk, T. P.; Pezzuto, J. M.; Braga, F. C., Selective inhibition of aromatase by a dihydroisocoumarin from Xytis pterygoblephara. Journal of Natural Products 2008, 71, 1082-1084.
5) Rossi, R.; Carpita, A.; Bellina, F.; Stabile, P.; Mannina, L., Synthesis of 3-arylisocoumarins, including thunberginols A and B, unsymmetrical 3,4-disubstituted isocoumarins, and 3-ylidenephthalides via iodolactonization of methyl 2-ynylbenzoates or the corresponding carboxylic acids. Tetrahedron 2003, 59, 2067-2081.
6) Tianpanich, K.; Prachya, S.; Wiyakrutta, S.; Mahidol, C.; Ruchirawat, S.; Kittakoop, P. Radical Scavenging and Antioxidant Activities of Isocoumarins and a Phthalide from the Endophytic Fungus Colletotrichum sp. Journal of Natural Products, v. 74, n. 1, p. 79-81, 2011.
7) BUNDY, G. L.; LIN, C. H.; SIH, J. C. The synthesis of 2,3-dinorprostacyclin metabolites- a new approach to spirolactone hemiacetals. Tetrahedron, vol. 37, p. 4419-4429,1981.
8) Weibel, N.; Charbonniere, L; Ziessel, R. Catalytic etherification of N-protected tris(hydroxymethyl)aminomethane for the synthesis of ligands with C3 symmetry. Tetrahedron Letters, vol. 47, p. 1793-1796, 2006.
9) Wang, L. L.; Zhang, X. J.; Jiang, Y. W.; Ma, D. W. An efficient synthesis of isocoumarins via a CuI catalyzed cascade reaction. Science in China Series B: Chemistry, v. 52, n. 10, p. 1616-1621, 2009.
































