síntese de derivadosTiazolo[3,4d] piridinas via reação multicomponente
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Paiva, R.K.C. (UEG) ; Ramos, L.M. (UEG)
Resumo
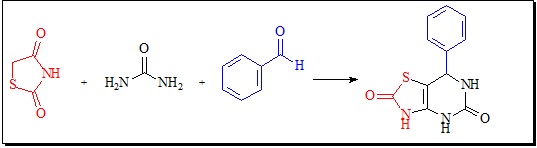
As 3,4diidropirimidin-2-(1H)ona (DHPMs) obtidas via reação multicomponente de Biginelli representam uma classe de que apresentam interessantes propriedades farmacológicas: antibacteriana, anti-inflamatória, antifúngica, anticancerígena, etc. Diferentes análogos de DHPMs vem sendo explorados em síntese orgânica, como a inserção do núcleo da tiazolidina-2,4-diona (TZD) que é conhecido por gerar distintos derivados com atividade biológica com o núcleo da DHPMs para a obtenção de compostos com potencial terapêutico. Diante do exposto o presente trabalho objetivou sintetizar diferentes derivados de DHPMs fundidos ao núcleo da TZD via reação de Biginelli. A partir da metodologia empregada, obteve-se o produto 7-fenil-1,4,6,7- tetrahidro-tiazolo [5,4-d]pirimidina-2,5-diona com rendimento 85%.
Palavras chaves
Multicomponente; Biginelli ; cinética
Introdução
Dentre as reações multicomponentes (RMCs) a reação de Biginelli é uma das mais conhecidas pelas atividades biológicas de seus produtos como: anticancerígena, antimalárica, antioxidante, antibacteriana entre outras. Devido a sua ampla gama de atividades biológicas compostos análogos a DHPMs vem sendo estudados (RAMOS et al., 2013; TARUNKUMAR et al., 2011). Em decorrência do potencial farmacológico dos derivados de DHPMs um olhar especial vem sendo dado a metodologia comumente empregada, visto que esta reação requer condições severas, longos tempos reacionais proporcionando baixos rendimentos do produto. Para superar essas desvantagens vários protocolos para a síntese de DHPMs foram desenvolvidos. Para melhorar a eficiência do processo, propuseram-se diferentes variações das condições experimentais: o uso de catalisadores tais como ácidos de Brönsted ou Lewis, líquidos iônicos, ou ainda excesso de reagente (ALVIM et al., 2014; KAPPE 2000). Vários derivados de DHPMs com potencial biológico vem sendo descobertos nos últimos anos, justamente devido a versatilidade desta reação que pode sofrer modificação não somente nas condiçõe reacionais mais também nos componentes envolvidos nesta reação, diferentes substratos vem sendo incorporados como por exemplo o núcleo da 2,4- tiazolidinadiona (TZD). Atividades biológicas tais como: antibacteriana, antifúngica (AYHAN-KILCIGI; ALTANLAR 2000), antidiabético (MACCARI et al., 2014) antidepressiva, anti-inflamatória, herbicida e dentre outras (LIESES et al., 2010) são expressas nos derivados da TZD. Diante do exposto o presente trabalho objetivou a sintetizar e purificar derivados de TZD acoplados a núcleos de DHPMs a partir da a otimização das condições reacionais: efeito catalítico, solvente e excesso de reagente no meio reacional.
Material e métodos
Inicialmente prosseguiu-se com a síntese da 2,4-tiazolidinadiona (TZD) de acordo com metodologia descrita na literatura (GOES et al., 2004). Em balão de fundo redondo adaptado para refluxo, preparou-se a solução de 10g de tiouréia (131,37mmol) e 12,4g de ácido monocloroacético (131,21 mmol) em 100 mL de água destilada, que foi mantida sob agitação magnética e refluxo por 18h a 80ºC, em seguida a mistura reacional foi deixada em geladeira por 24h, e posteriormente em congelador obtendo-se cristais brancos que foram tratados por filtração a vácuo com água gelada. Posteriormente submeteu-se a TZD a reação de Biginelli em balão de fundo redondo adaptado para refluxo adicionou-se 1 equivalente de ureia, Benzaldeído e 2,4-tizaolidinadiona a mistura foi mantida em agitação constante por 2 horas a 80°C. Afim de se otimizar as condições reacionais empregou-se diferentes catalisadores ácidos, básicos e Liquidos iônicos, solventes, e o excesso de equivalentes no meio reacional.
Resultado e discussão
A reação foi realizada conforme esquema 1.
Os resultados obtidos demonstraram maior eficiência catalítica do imidazol
no meio reacional empregando-se 1,45mmol do mesmo. Avaliações posteriores
para a otimização do tempo reacional e efeito de solvente permitiu verificar
maior rendimento do produto ao utilizar 1mL de THF e 2h de refluxo a 80ºC.
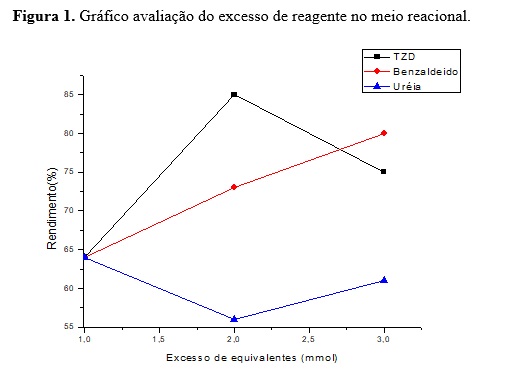
Em seguida procedeu-se a avaliação do excesso de equivalentes no meio
reacional (Figura 1).
Como pode ser observado na Figura 1 o excesso de equivalentes de TZD no meio
favoreceu maior rendimento do produto quando comparada ao excesso do
benzaldeido e ureia. Foram avaliadas as melhores condições reacionais para
síntese de um derivado de Biginelli empregando um catalisador atóxico
contribuição aos princípios da química verde.
Conclusões
Diante dos resultados obtidos pode-se concluir que a metodologia empregada contribuiu para a obtenção do produto de interesse. A metodologia faz juz aos princípios da química verde uma vez que a rota sintética empregada é altamente convergente favorecendo a obtenção do composto via única etapa de reação e isolamento com rendimento satisfatório. O sistema catalítico preferencial envolvido nesta metodologia foi básico o que difere da reação clássica de Biginelli que se dá via catalise ácida.
Agradecimentos
CAPES - FAPEG, CNPq, UEG, Bolsa BIP e Pró-projeto pesquisa edital 026/2016.
Referências
ALVIM, H. G. O.; JUNIOR, E. N. S.; NETO, B. A. D. What do weknow about multicomponent reactions? Mechanisms and trends for the Biginelli, Hantzsch, Mannich, Passerini and Ugi MCRs. Royal society of chemistry, v. 20, p. 1-18, 2014.
AYHAN-KILCIGIL, G., ALTANLAR, N Synthesis of 3 – substituted phenacyl – 5 – 2- phenyl -4H- 4- oxo- 1 – benzopyran – 6- yl menthylenyl- thiazolidine – 2,4 – diones and evaluation of their antimicrobial activity, Arzneimittel forschung. v. 50, n.2, p. 154–157. 2000.
GÓES, A. J. S.; LIMA, W. T.; MAGY, H. J.; ALVES, A. J.; FARIA, A. R.; LIMA, J. G.; MAIA, M. B. S. Síntese e atividade antiedematogênica de derivados N-triptofil-5-benzilideno-2,4-tiazolidinadiona e N-triptofil-5-benzilideno-rodanina, Química nova, v.27, n.6, p.905-910, 2004.
KAPPE, C.O. Biologically active dihydropyrimidones of the Biginelli-type — a literature survey, European Journal of Medicinal Chemistry, v.35, n.12, p. 1043 – 1052, 2000.
LIESSE, A. P.; AQUINO, T. M.; CARVALHO, C. S.; LIMA, V. T.; ARAUJO, J.M.; LIMA, J. G.; Faria, A. R.; MELO, E. J.T.; ALVES, A. J. T.; ALVES, E . W.; ALVES, A. Q.; GOES, A, J. S. Synthesis and evaluation of anti – Toxoplasma gondii and antimicrobial activities of thiosemicarbazides, 4 – thiazolinones and 1,3,4 – thiadiazoles, European Jounal of Medicinal Chemistry, v.45, n.9, p. 3685 – 3691, 2010.
MACARI, R.; VITALE, R. M.; OTANNÁ, R.; ROCCIOLI, M.; MARRAZZO, A.; CARDILE, A. C. E.; AMODEO, P., MURA, U.; CORSO, del A.Structureactivity relationships and molecular modelling of new 5-arylidene-4-thiazolidinone derivatives as aldose reductaseinhibitors and potential anti-inflammatory agents, European Journal of Medicinal Chemistry, v. 81, p. 1 -14, 2014.
RAMOS, L. M.; GUIDO, B.C.; NOBREGA, C. C.; CORRÊA, J.R.; SILVA, R. G.; OLIVEIRA, H. C.B.; GOMES, A.F.; GOZZO, F. C., NETO, B. A. S. The Biginelli Reaction with an Imidazolium–Tagged Recyclable Iron Catalyst: Kinetics, Mechanism, and Antitumoral Activity Chemistry a European Journal, v.19, n.3, p. 4156 –4168, 2013.
TARUNKUMAR, N. A; RAVAL, J. P. 1,3-dihydro-2H-indol-2-ones derivatives: Design, Synthesis, in vitro antibacterial, antifungal and antitubercular study, European Journal of Medicinal Chemistry, v. 46, p. 5573-5579, 2011.
































