Síntese e caracterização de chalconas
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Lemes, E.O. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Awad, R. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Queiroz, J.E. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Vidal, H.D.A. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Machado, I.V. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Aquino, G.L.B. (UNIVERSIDADE ESTADUAL DE GOIÁS)
Resumo
O interesse da síntese de chalconas e a sua utilização está relacionado a sua estrutura e também as possibilidades de modificações que ela apresenta em relação ao mecanismo de estrutura e atividade. A realização deste estudo objetivou em sintetizar e purificar diferentes chalconas. Para a síntese foi utilizado diferentes acetofenonas e benzaldeidos, com o emprego de KOH como catalizador. Foram sintetizadas 15 chalconas, estas tiveram rendimento entre 75 a 95%. As chalconas que tinham grupos substituintes com forte poder doador de elétrons, como metoxi, tiveram rendimentos mais baixos, o aumento do rendimento é adquirido a medida que grupos substituintes são trocados, por grupos com menor poder de doador de elétrons. A presença dos grupos substituintes alterou os rendimentos das chalconas.
Palavras chaves
Chalconas; Síntese ; Purificação
Introdução
Os flavonoides são um dos maiores grupos de metabolitos secundários de origem natural com ampla atividade biológica, são constituídos por três anéis fenólicos, possui um anel benzeno que é condesado com o sexto carbono do terceiro anel e o terceiro se apresenta na forma pirona. Possui ação anti-inflamatória, antialérgica e antioxidante. Suas principais classes são flavonóis, flavonas, flavanas, isoflavonoides e antocianinas (VENTURELLI et al., 2016; JABEEN, 2017). As chalconas são consideradas flavonoides de cadeia aberta amplamente distribuídas no reino vegetal, são produtos intermediários e finais na biossíntese de flavonoides, considerados importantes na pigmentação de flores. Possui a função atrativa para polinização, além de desempenharem ação contra patógenos e insetos. Apesar da sua ocorrência em plantas, podem ser sintetizadas também em laboratório. As chalconas possuem atividade antioxidante, anticâncer, antimicrobiana, anti-inflamatória e outras. São alvos de interesse por pesquisadores em universidades e pela indústria farmacêutica (BATOVSKA; TODOROVA, 2010). O interesse da síntese de chalconas e a sua utilização está relacionado a sua estrutura e também as possibilidades de modificações que esta apresenta em relação ao seu mecanismo de estrutura e atividade. São características básicas desta a abertura de um terceiro anel, presentes nas classes de flavonoides, o que torna possível a formação de uma ligação dupla com os carbonos denominados α e β na função carbonila (VENTURELLI et al., 2016). As chalconas são classificadas como cetonas α,β-insaturadas, os grupamentos aromáticos são conectados a três carbonos referentes a porção olefinica e carbonila, apresentam núcleo 1,3-diarilprop-2-en-1-ona, excelentes no desenvolvimento de fármacos (MARIÑO et al., 2015).
Material e métodos
Para a síntese das chalconas uma mistura de aldeído aromático e acetofenona em uma quantidade de 1 ml de etanol absoluto, KOH sólido em pó foi adicionado. A mistura foi agitada à temperatura ambiente até a precipitação ou a formação de um sistema bifásico, a mistura reacional foi arrefecida e o sólido foi separado por filtração e recristalização em etanol para gerar as respectivas chalconas. Para verificar a pureza dos produtos foi empregada cromatografia em coluna delgada e para a caracterização foi empregada cromatografia gasosa acoplada à espectrometria de massa (CG/MS), foi utilizado um cromatógrafo gasoso acoplado a um detector de espectrometria de massas da Shimadzu, modelo GCMS-QP2010 Ultra. As alíquotas foram injetadas manualmente, através da utilização de uma seringa de 0,5 ml, foi empregado o Hélio com pureza de 99,999% como gás de arraste, com fluxo de coluna de 1 ml/min-1, temperatura do injetor 250 °C. A temperature inicial foi de 80°C, isoterma por 3 min, aumentou de 80°C para 280°C a 10°C/min-1 e isoterma por 25 min. Os picos foram identificados com o auxílio da utilização do programa ChemDraw ultra 8.0, com a utilização das informações da formula molecular e estrutural das chalconas. Quando necessário os compostos foram purificados por recristalização com etanol a quente, as chalconas caracterizadas e puras foram armazenadas em frascos de penicilina.
Resultado e discussão
Foram sintetizadas 15 chalconas, estas tiveram rendimento entre 75 a 95%. A
mudança nos rendimentos é consequência da presença de substituintes, ligados ao
anel do aldeído, que influenciam no rendimento dessas reações. As chalconas que
tinham grupos substituintes com forte poder doador de elétrons, como metoxi,
tiveram rendimentos mais baixos, o aumento do rendimento é adquirido a medida que
grupos substituintes são trocados, por grupos com menor poder de doador de
elétrons. A reatividade dos aldeídos é influenciada pela posição que os
substituintes se encontram ligados ao anel. Os grupos que são doadores de
elétrons ligados ao anel na posição para em relação a um substituinte qualquer
tendem a estabilizar melhor o anel, esta estabilidade tem uma relação direta com
a posição orto, meta ou para. Os espectros de massas obtidos possibilitaram a
caracterização de cada chalcona (Figura 1).
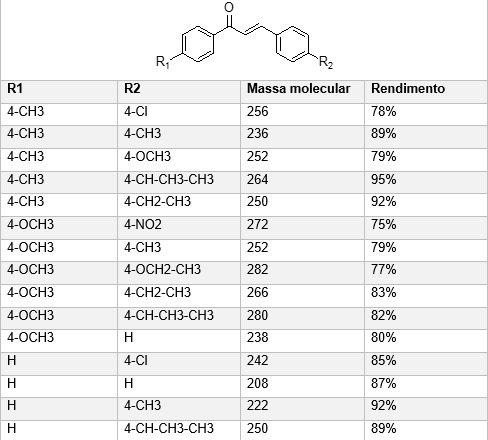
Análise das chalconas sintetizadas com os resultados dos rendimentos e caracterização por cromatografia gasosa acoplada à espectrometria de massa.
Conclusões
Os dados obtidos da síntese e caracterização por CG/MS das chalconas sintetizadas, demonstraram que a presença dos grupos substituintes alterou o rendimento e possibilitou a confirmação dos produtos obtidos. A presença de grupos doadores de elétrons, localizados na posição para, diminuem o rendimento, e grupos como etil e metil que são fracos doadores de elétrons, aumentam o rendimento das reações.
Agradecimentos
Fundação de Amparo à Pesquisa do Estado de Goiás (FAPEG) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
Referências
BATOVSKA, D. I.; TODOROVA, I. T. Trends in utilization of the pharmacological potential of chalconas. Current Clinical Pharmacology, v. 5, n. 1, p. 1-29, 2010.
JABEEN, E. Radical scavenging propensity of Cu2+, Fe3+ complexes of flavonoids and in vivo radical scavenging by Fe3+-primuletin. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, v. 171, p. 432-438, 2017.
MARIÑO, P, A. et al. In vitro and in silico toxicity evaluation of bioactive 4’-aminochalcone derivatives. Drug and Chemical Toxicology, p. 1-6, 2015.
VENTURELLI, S. et al. Prenylated chalcones and flavonoids for the prevention and treatment of cancer. Nutrition, v. 32, p. 1171-1178, 2016.
































