Síntese, Caracterização e Avaliação citotóxica de quarto novas chalconas
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
da Silva, P.T. (UVA) ; da Silva Bomfim, I. (UFC/NPDM) ; Bandeira, P.N. (UVA) ; Lemos, T.L.G. (UFC) ; Santos, H.S. (UVA) ; Teixeira, A.M.R. (URCA) ; de Moraes, M.O. (UFC/NPDM) ; Barros-nepomuceno, F.W.A. (UNILAB) ; Pessoa, C. (UFC/NPDM/FIOCRUZ)
Resumo
Quatro novas chalconas foram sintetizadas: (2E) -1- (4’-aminofenil) -3- (3'- nitrofenil) prop-2-en-1-ona (1), (2E) -1- (3-metoxi-4-hidroxifenil) -3- (3'- nitrofenil) -prop-2-en-1-ona (2), N- {4 '- [(2E) -3- (4-etoxyfenil) -1- (fenil) prop- 2-en-1-ona] acetamida (3), N- {4 '- [(2E) -3- (3-nitrofenil) -1- (fenil) prop-2-en- 1-ona] acetamida (4). A atividade citotóxica das chalconas foi determinada pelo método do MTT usando 3 linhagens celulares de câncer humano: HCT-16 (carcinoma de cólon), PC-3 (adenocarcinoma de próstata) e HL-60 (leucemia promielocítica). O composto (4) destacou- se por apresentar forte e seletiva atividade citotóxica (RVC% = 89,4 %; CR50 = 2,4) contra células tumorais HCT-16 após 72h de incubação, vindo a ser uma molécula “hit” na descoberta de novos fármacos anticâncer.
Palavras chaves
Chalconas; síntese; citotoxidade
Introdução
Chalconas são cetonas α, β-insaturadas, que apresentam em sua estrutura simples o núcleo 1,3-diarilprop-2-en-1-ona (ÁVILA et al., 2008) e o esqueleto C6-C3- C6. Seus dois estereoisômeros, Z e E, são precursores comuns na biossíntese de flavonóides e isoflavonóides. Chalconas e seus derivados são substâncias de grande interesse químico-farmacológico e tem recebido uma grande atenção devido sobretudo a sua estrutura relativamente simples e a diversidade de atividade farmacológica que apresenta (DIMMOCK et al., 1999; NI et al., 2004; NOWAKOWSKA, 2007). Chalconas se constituem em uma família de pequenas moléculas com abundância natural em plantas, apresentando propriedades antitumoral em células cancerígenas específicas. Nosso objetivo foi sintetizar novas chalconas e testá-las suas atividades citotóxicas frente a linhagem especificas de células cancerígenas. Suas Estruturas foram determinas pelo uso das técnicas de RMN de 1H e 13C uni e bidimensionais, IV e espectrometria de massas.
Material e métodos
As chalconas foram sintetizadas por reações de condensação aldólica de Claisen-Schmidt em meio básico, utilizando p-aminoacetofenona e 3-metoxi-4- hidroxiacetofenona com derivados do benzaldeído. Foi tomado 2 mmol dos derivados de benzaldeído, dissolvidos em 5 mL de etanol. Acrescentou-se 10 gotas de uma solução de hidróxido de sódio 50% deixando-se sob agitação por 2 minutos. Acrescentou-se a esta mistura 2 mmol de p- aminoacetofenona ou 3-metoxi-4- hidroxiacetofenona dissolvidos em 5 mL de etanol sob agitação magnética a temperatura ambiente por um período de 48 horas e monitorada em CCD. Após terminada a reação o precipitado foi filtrado e lavado com H2O gelada até pH neutro. O produto formado foi avaliado em CCD e purificado por recristalização em etanol. As 4’-acetamidachalconas foram obtidas por reações de acetilação de 4’- aminochalconas com anidrido acético em meio tamponado com ácido acético/acetato de sódio em pH =5, sob agitação magnética, a temperatura ambiente por 60 minutos. Os espectros de RMN foram obtidos utilizando- se Espectrômetros de Bruker, modelo, Avance DPX – 300 e DRX-500 que operam na frequência de 300 MHz e 500 MHz para hidrogênio, 75 MHz e 125 MHz para carbono. Os espectros de infravermelho foram obtidos no espectrômetro Perkin-Elmer, modelo 1000-FT. Os espectros de massas foram obtidos em CG-EM QP201 da SHIMADZU. A citotoxicidade das amostras foi avaliada pelo método do MTT. As células neoplásicas foram plaqueadas em placas de 96 poços (0,7 x 105 células/mL) e as amostras foram adicionadas após 24 h. Após incubação por 72 h em estufa a 5 % de CO2 e 37 °C, as absorbâncias foram obtidas com o auxílio de um espectrofotômetro de placa a 595 nm.
Resultado e discussão
Os espectros de RMN de 13C apresentaram
sinais característicos de cetona (C=O)
conjugada ao sistema α, β-insaturado.
Revelaram também sinais para o Cα e Cβ
característicos de enonas (Tabela 1). Além
disso, os sinais de 1H em C-sp2 foram
observados formando dubleto com valores
característicos de hidrogênios trans.
Estas informações justificam o previsto
para a síntese de chalconas na geração da
ligação dupla conjugada com C=O. Os
valores de RMN 13C estão expressos na
tabela 1. Os dados de infravermelho
corroboraram na confirmação da estrutura,
afirmando a presença de bandas de
estiramento características de C=O com
valores de sistema conjugado a C-sp2 e
bandas de estiramento de =C-H do tipo
trans demonstrando a formação da ligação
dupla C=C. Os dados foram confrontados com
a literatura de chalconas de estruturas
similares. Em relação à citotoxicidade
antitumoral in vitro, percebeu-se que o
RVC % variou de 8,20 a 89,38 % (Tabela 2),
revelando que pequenas modificações na
estrutura química das chacolnas foram
suficientes para alterar a atividade
biológica. Os resultados indicaram que o
composto (4) destacou-se por promover
redução significativa da viabilidade de
células HCT-116 (RVC % = 89,38 ± 1,48)
sendo, portanto, selecionado para a
determinação de CR50 em 3 linhagens
celulares de câncer. Desta forma, o
composto (4) apresentou forte e seletiva
atividade citotóxica em células HCT-116,
sugerindo que deve haver alguma
característica específica e necessária
para esse tipo de tumor que deve estar
sendo afetada pelo composto (4) nas
concentrações testadas.
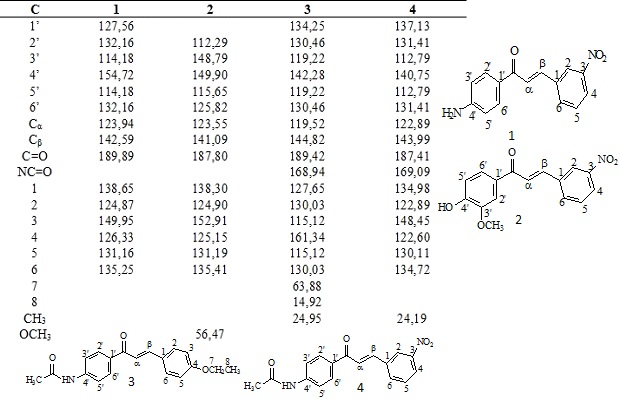
Dados de RMN de 13C (75 MHz) das chalconas 1-4

Citotoxicidade das amostras em células HCT-116 testadas em concentração única (10 µM).
Conclusões
Os dados de RMN associados as informações de IV, dados de massas e em comparação com dados da literatura de chalconas análogas, confirmaram a formação de quatro novas chalconas. A chalcona N-{4 '- [(2E) -3- (3-nitrofenil) -1- (fenil) prop-2-en-1-ona] acetamida é portadora de uma forte e seletiva atividade citotóxica em células HCT-116, nos dando a perspectiva para a realização de estudos sobre o mecanismo de ação do referido composto usando ensaios in vitro e in vivo com o intuito de agregar valor antitumoral ao produto natural desenvolvido.
Agradecimentos
Os autores agradecem o CENAUREM pela realização dos espectros de RMN e, também ao Instituto Nacional do Câncer (EUA) por ceder as linhagens celulares tumorais
Referências
ÁVILA, H.P.; SMÂNIA, E.F.; MONACHE, F.D.; JUNIOR, A.S. Structure-activity relationship of antibacterial chalconas. Bioorganic. & Medicinal Chemistry. v. 16, p. 9790 – 9794, 2008.
DIMMOCK, J.R.; ELIAS, D.W.; BENAZELY, M.A.; KANDEPU, N.M. Bioactivities of chalconas. Current Medicinal Chemistry, v. 6 (12), p. 1125 – 11249, 1999.
MOSMANN, T. 1983. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J.Immunol. Methods, v.65, p 55-63.
NI, L.; MENG, C.Q.; SIKOKSKI, J.A. Recent advances in therapeutic chalcones. Expert Opinion on Therapeutic Patents, v. 14(12), p. 1669 – 1691, 2004.
NOWAKOWSKA, Z.A. A review of anti-inflammatory chalcones. European Journal of Chemistry, v. 42, p. 125 – 137, 2007.
































