Síntese e Avaliação de Derivados de Chalconas frente a Acetilcolinesterase e BACE1
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Antoniolli, G. (UNICAMP) ; Almeida, W.P. (UNICAMP) ; Lancellotti, M. (UNICAMP) ; Sakata, R.P. (UNICAMP)
Resumo
Neste trabalho, apresentamos os resultados de nossa pesquisa sobre a atividade de 2’-aminochalconas sobre alguns marcadores da Doença de Alzheimer: acetilcolinesterase (AChE) e β-secretase (BACE-1), envolvidas no déficit colinérgico e na formação de placas amiloides, respectivamente. As chalconas foram obtidas por uma reação de condensação de Claisen-Schmidt entre um aldeído aromático substituído e a orto-aminoacetofenona. A avaliação in vitro do efeito sobre a atividade da AChE revelou que as substâncias inibem significativamente a atividade enzimática, com valores de CI50 da ordem micromolar, muito inferior à concentração necessária para afetar células viáveis. As chalconas também foram avaliadas para a BACE-1 e o efeito inibitório máximo foi de 80%.
Palavras chaves
chalconas; toxicidade; Alzheimer
Introdução
A Doença de Alzheimer (DA) é uma doença neurodegenerativa, progressiva e irreversível, relacionada à idade. O aumento do número de casos deve ser exponencial, em função do envelhecimento da população, e não há tratamentos efetivos. (ALZHEIMER’S ASSOCIATION, 2017). Essa realidade torna a busca por substâncias capazes de melhorar a condição do paciente, ou retardar o avanço da doença, um grande desafio. A Doença de Alzheimer tem uma característica multifatorial e existem várias hipóteses elencadas na sua fisiopatologia. Destacam-se a hipótese colinérgica, amiloide e da proteína tau. A primeira hipótese relaciona o declínio cognitivo característico da doença, à diminuição do neurotransmissor acetilcolina, que participa dos processos de aprendizagem, memória e linguagem, dentre outros. Assim, o desenvolvimento de inibidores da acetilcolinesterase (AChE), enzima responsável pela hidrólise da acetilcolina, é uma das estratégias para a descoberta de fármacos para o tratamento da DA. Apesar de algumas controvérsias, dos quatro fármacos que se encontram no mercado utilizados no tratamento da DA, três são inibidores da AChE: donepezila, galantamina e rivastigmina. O processamento anormal da proteína precursora do amiloide, promovido pelas enzimas β e γ-secretases, leva à formação de fragmentos de peptídeos, principalmente com 42 resíduos de aminoácidos (Aβ42), que tem propriedades auto-agregantes, e forma oligômeros neurotóxicos e fibrilas que se depositam em placas extracelulares denominadas placas neuríticas ou senis. De acordo com a hipótese amiloide, a formação desses oligômeros e dessas placas, compromete a função sináptica, desencadeia uma resposta inflamatória, levando à morte neuronal. Assim, substâncias capazes de interferir nessa cascata de eventos amiloidogenicos, vem sendo alvo de numerosos estudos. Chalconas são quimicamente substâncias que apresentam em sua estrutura um anel aromático ligado a outro, através de um sistema carbonílico α,β- insaturado. O grande interesse nessa classe de substâncias, naturais ou sintéticas, reside no fato de que são facilmente sintetizadas, e é possível preparar série de compostos com grande variedade estrutural, simplesmente modificando-se os substituintes do anel aromático, com características eletrônicas e/ou estéricas diferentes. Essa versatilidade é extremamente importante em Química Medicinal, par aos estudos de relações estrutura- atividade. Além disso, devido à presença da ligação dupla conjugada com a carbonila, essa classe pode ser utilizada como precursor sintético para a obtenção de intermediários sintéticos importantes. Em relação à atividade biológica, as chalconas tem um perfil bastante amplo, sendo descritas propriedades antimicrobianas, anticâncer e antiviral (BUKARI, et.al., 2012). Entretanto, pouco se sabe sobre o seu efeito frente aos marcadores da Doença de Alzheimer. O nosso grupo de pesquisa tem se dedicado ao planejamento, síntese e avaliação de substâncias com potencial atividade sobre marcadores da Doença de Alzheimer (ALMEIDA, et.al., 2016), e, dentre as classes estudadas, se encontram as chalconas. Com base em estudos de docking molecular, identificamos a necessidade da presença de um grupo amino, próximo espacialmente a um grupo aceptor de hidrogênio, para ter uma boa interação com a enzima. Assim, selecionou-se para estudo uma série de 2’-aminochalconas.
Material e métodos
As chalconas foram sintetizadas por uma reação de condensação de Claisen- Schimdt (CLAISEN E CLAPAREDE, 1881), envolvendo um aldeído aromático substituído e a orto-aminoacetofenona. A base utilizada foi hidróxido de sódio (NaOH), e o solvente, metanol. A reação se deu à temperatura ambiente, sob agitação magnética e foi monitorada por cromatografia em camada delgada (CCD). Quando a análise da placa de CCD, revelada por luz ultravioleta (254 nm), mostrou o consumo do material de partida, o sólido obtido foi coletado por filtração e lavado com metanol e água gelada. O material foi seco à temperatura ambiente e, quando necessário, recristalizado em etanol. Todos os produtos foram analisados por espectroscopia no Infravermelho e Ressonância Magnética Nuclear de 1H e 13C. A atividade anticolinesterásica foi avaliada pelo método colorimétrico de Ellman. (ELLMAN et.al., 1961). A enzima oriunda de peixe elétrico foi adquirida da Sigma Aldrich Brasil. Os testes foram realizados em triplicata, seguindo protocolo estabelecido em nosso laboratório. Tacrina e donepezila foram utilizados como controle positivo de inibição. Com o objetivo de determinar os valores de CI50 (concentração inibitória mínima para inibir a atividade enzimática em 50%), os testes foram realizados em várias concentrações. Os valores de CI50 foram calculados pelo Origin 8.1. Os ensaios de inibição da BACE-1 foram realizados pelo método de FRET (Fluorescence Resonance Energy Transfer – Transferência de Energia de Ressonância por Fluorescência), BACE-1 utilizou-se o kit comercializado pela empresa Thermo Fisher Scientific (número de catálogo: P2985), seguindo o protocolo indicado pela mesma. Os testes de viabilidade celular foram realizados com três linhagens celulares diferentes. As linhagens Vero (rim de macaco) e 3T3 (fibroblastos de camundongos) foram inicialmente utilizadas, sendo recomendadas para citotoxicidade pela International Organization for Standardization (ISO10993-5 e 10993-1). Nesse estudo, também incluímos a linhagem M059J (glioma), que é de tecido nervoso, uma vez que é onde se espera a atuação desses compostos. As células viáveis reduzem o MTT que é absorvido por elas por endocitose, e no seu interior, gerando os cristais de formazan, que é o produto de redução do MTT pelas células. O formazan é excretado e detectado por colorimetria. (LIU, et.al., 1997). Os valores são expressos em porcentagens de MTT reduzido comparado ao controle, que correspondem às células que não foram expostas aos compostos-teste. Estudo de docking molecular com a BACE-1 foi realizado com a estrutura cristalográfica depositada no PBD com o código 4ZPF, e foi utilizado o programa Autodock Vina.
Resultado e discussão
Todos os produtos foram caracterizados por métodos espectroscópicos e
utilizados nos ensaios biológicos com alto grau de pureza.
No espectro de infravermelho, é possível identificar a absorção
característica do estiramento da ligação N–H do grupo amida, que aparece com
sinal em 3158 cm-1. Além dessa absorção, os sinais mais
característicos foram os das absorções das carbonilas (C=O) da amida em 1680
cm-1 e da cetona em 1648 cm-1 o que comprova a
eficácia da síntese, além disso, a absorção da ligação dupla (C=C), em 1585
cm-1. No espectro de RMN-1H destaque para os dubletos
correspondentes aos hidrogênios vinílicos α e β (7,58 e 7,80 ppm,
respectivamente), com constante de acoplamento de 15,6 Hz, característica da
configuração E, e para o singleto correspondente ao hidrogênio do grupo
amida em 12,31 ppm e dos hidrogênios metilênicos em 4,25 ppm.
Inibição da Acetilcolinesterase e BACE-1
Todas as chalconas avaliadas apresentaram efeito inibitório sobre a
acetilcolinesterase. Os valores de CI50 se encontram na Tabela 1.
A chalcona mais potente foi a chalcona 3, tanto para inibição da AChE quanto
da BACE-1. Os resultados obtidos para essa última foram comparados com
outros obtidos anteriormente no laboratório, e observamos que as chalconas
que não apresentam o grupo amino na posição orto à carbonila não têm
efeito inibitório sobre a BACE-1. A presença do grupo amino é fundamental
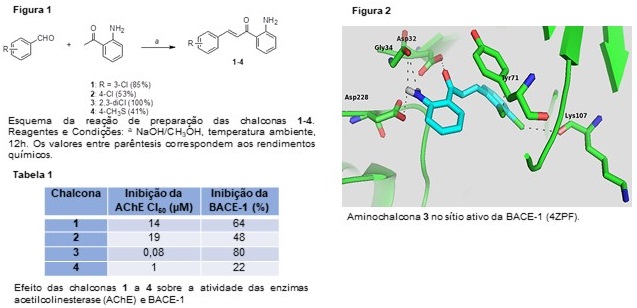
para a interação com a BACE-1. Observa-se, na Figura 2, uma ligação de
hidrogênio bem próxima entre o grupo amino da 2’-aminochalcona e o oxigênio
presente no resíduo de aminoácido Asp228 (2,5 Å) e outra ligação entre a
carbonila do composto e o grupo OH do Asp32 (3,4 Å). Estes dois resíduos de
aminoácido são muito importantes na inibição da enzima pois integram a díade
catalítica desta enzima, sendo assim quando o composto interage com estes
impede a interação com o substrato natural da enzima. A energia de interação
foi de 7,5 kcal/mol.
Viabilidade celular
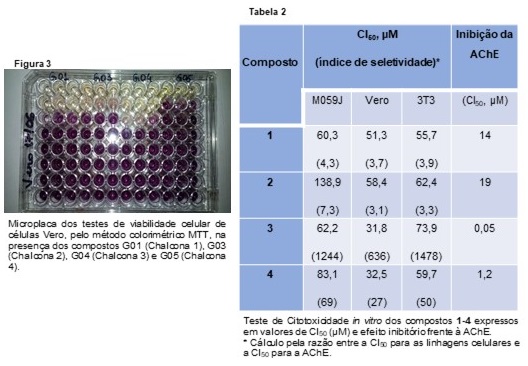
O efeito desses compostos sobre a viabilidade de três linhagens celulares
também foi estudado. A Figura 3 apresenta uma das microplacas do teste de
viabilidade (Células Vero). Somente nas concentrações mais altas (linhas
superiores) se observa uma região mais clara que denota um número menor de
células viáveis.
Observou-se que a concentração necessária para inibir o crescimento celular
é muito superior à concentração inibitória, sugerindo que o efeito
anticolinesterásico desejado pode ser alcançado sem afetar células viáveis.
Os valores de CI50 estão dispostos na Tabela 2.
Conclusões
Nesse trabalho foram sintetizadas quatro aminochalconas que apresentaram efeito inibitório sobre dois marcadores importantes para a Doença de Alzheimer: as enzimas acetilcolinesterase e β-secretase (BACE-1). A chalcona derivada do 2,3-diclorobenzaldeído foi o inibidor mais potente para ambas as enzimas. Os compostos sintetizados não apresentaram efeito citotóxico significativo frente a três linhagens celulares.
Agradecimentos
Ao Instituto de Química da UNICAMP, onde esse trabalho foi realizado e ao Labiotec da Faculdade de Ciências Farmacêuticas da Unicamp, onde forma realizados os testes
Referências
CLAISEN, L.; CLAPAREDE, A. Ber Dtsch Chem Ges, 14 (1881), 2460-2468.
LIU, Y.; PETERSON, D.A.; KIMURA, H.; SCHUBERT, D. J. Neurochem. 69 (1997), 581-593.
MOSMANN, T. J. Immunol. Methods, 65 (1983), 55–63.
BUKARI, S.; JASAMAI, M.; JANTAN, I. Mini-Rev. Med. Chem., 12 (2012), 1394-1403.
ELLMAN, G.L.; COURTNEY, K.D.; ANDRE V. Jr.; FEATHERSTONE, R.M. Biochem. Pharmacol. 7 (1961), 88–95.
ALMEIDA, W. P.; DA SILVA, G.S.; FIGUEIRÓ, M.; TORMENA, C.F.; COELHO, F. J.
Enzyme Inhib. Med. Chem., 31 (2016), 1464-1470.
ALZHEIMER’S ASSOCIATION. Alzheimer’s Dement., 13 (2017) 325-373.
































