SÍNTESE DA 6,8-DI-IODO-3,7,3’,4’-TETRAMETOXI-QUERCETINA
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Ramos, I.T.L. (UFRPE) ; Camara, C.A. (UFRPE)
Resumo
Derivados halogenados, assim como, a 6,8-di-iodo-3,7,3’,4’-tetrametoxi- quercetina são importantes na síntese orgânica por serem possíveis intermediários em diversas reações. Nesse trabalho são mostrados dois novos métodos de obtenção do derivado 6,8-di-iodado.
Palavras chaves
Iodo-flavonoides; Retusin; Di-iodação
Introdução
Derivados halogenados de flavonóides com o iodo, ainda são raros na literatura. Apesar disso, são importantes intermediários para a síntese orgânica. Entre as mais recentes está a obtenção de um biflavonóide derivado da luteolina (Lu, et al, 2017). Na literatura já existe a obtenção dos derivados mono-iodados do retusin (3,7,3’,4’-tetrametoxi-quercetina) (1), mas ambas não trazem uma alternativa para a obtenção do di-iodado deste mesmo derivado (Carvalho, et al, 2009; Lu, et al, 2013). Neste trabalho são mostrados dois novos métodos para a obtenção da 6,8-di-iodo-3,7,3’,4’- tetrametoxi-quercetina (4) partindo das 6-iodo (2) e 8-iodo-3,7,3’,4’- tetrametoxi-quercetina (3).
Material e métodos
Preparação da 6,8-di-iodo-3,7,3’,4’-tetrametoxi-quercetina (4): Metodologia A: Adicionou-se 48,4 mg (0,1 mmol) da 6-iodo-3,7,3’,4’- tetrametoxi-quercetina (2) em uma solução de KOH (67,2 mg; 1,2 mmol) em 1 mL de MeOH. Em seguida adicionou-se pouco a pouco a solução de I2 (76,2 mg; 0,3 mmol) em 2 mL de MeOH. Ao término da reação (3 hs) monitorada por CCD, foi realizada uma neutralização com uma solução de HCl 10% e em seguida adicionou-se 10 mL de CH2Cl2. Após a adição de CH2Cl2, foi realizada uma extração com Na2S2O3 5 % (2x 10 mL). A fase orgânica foi seca em rotaevaporador à vácuo. A purificação foi realizada em coluna cromatográfica em sílica gel, utilizando como fase móvel um sistema de diclorometano: hexano 9:1 fornecendo o produto com 56% de rendimento. Metodologia B: Adicionou-se em pequenas porções 44,9 mg (0,2 mmol) de NIS na 8-iodo-3,7,3’,4’-tetrametoxi-quercetina (3) (48,4 mg; 0,1 mmol) e misturou- se até ficar um sólido homogêneo. O bruto reacional foi purificado em coluna de sílica gel, utilizando como fase móvel um sistema de diclorometano: hexano 9:1 fornecendo o produto com 63% de rendimento.
Resultado e discussão
Segundo Carvalho et al, 2009, a iodação no retusin pode formar dois produtos
isômeros, a 6-iodo (2) e 8-iodo-3,7,3’,4’-tetrametoxi-quercetina (3), mas que
nas condições utilizadas há uma regiosseletividade para a posição C8, tendo
como produto majoritário o isômero nesta posição. Lu et al, 2013, desenvolveu
uma metodologia que favorecia a posição C6, obtendo como produto majoritário a
6-iodo-3,7,3’,4’-tetrametoxi-quercetina (3). Como não foi apresentado uma
alternativa para a obtenção da 6,8-di-iodo-3,7,3’,4’-tetramentoxi-quercetina
(4), inicialmente utilizamos as metodologias anteriores com modificações
partindo dos isômeros 8- e 6-, a fim de disponibilizar a alternativa de
obtenção do derivado 6.8-di-iodado (4) (esquema 1). Na metodologia A houve
apenas a modificação na quantidade de I2, enquanto que na metodologia B, além
dessa modificação, foi alterado a utilização do solvente, onde a reação
utilizava DMF e possui um tempo reacional de 10 horas passou a ser uma reação
sem solvente com duração de apenas 5 minutos. O resultado dessas reações foi a
obtenção do produto 6,8-di-iodo-3,7,3’,4’-tetrametoxi-quercetina (4) com
rendimento de 56% (metodologia A) e 63% (metodologia B).
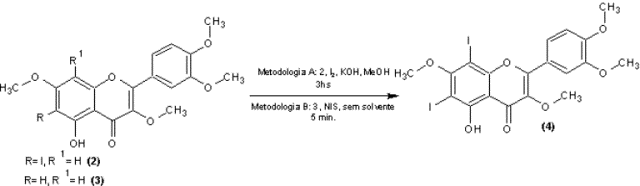
Síntese da 6,8-di-iodo-3,7,3’,4’-tetrametoxi- quercetina.
Conclusões
O trabalho apresenta duas altenativas para a obtenção da 6,8-di-iodo-3,7,3’,4’- tetrametoxi-quercetina com materiais acessíveis e ambientalmente amigáveis.
Agradecimentos
CNPq e CAPES pelo apoio financeiro.
Referências
Carvalho, M. G. D. E., Silva, V. C. D. A., & Silva, T. M. S. D. A. (2009). New iodine derivatives of flavonol and isoflavone. Annals of the Brazilian Academy of Sciences, 81(1), 21–28.
Lu, K., Chu, J., Wang, H., Fu, X., Quan, D., Ding, H., … Yu, P. (2013). Regioselective iodination of flavonoids by N-iodosuccinimide under neutral conditions. Tetrahedron Letters, 54(47), 6345–6348.
Lu, K., Yang, K., Jia, X., Gao, X., Zhao, X., Pan, G., … Yu, P. (2017). Total synthesis of I3,II8-biapigenin and ridiculuflavone A. Organic Chemistry Frontiers, 4, 578–586.
































