Síntese de derivados 6-alquilamino-5,8-quinolinoquinonas a partir de uma direta aminação nucleofílica da 7-bromo-5,8-quinolinoquinona
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Gomes da Silva, M. (IFAL) ; de Amorim Camara, C. (UFRPE)
Resumo
Neste trabalho, uma série de derivados 6-alquilamino-5,8-quinolinoquinona foi sintetizada a partir da adição nucleofílica de aminas (primárias e secundárias) na 7-bromo-5,8-quinolinoquinona. O presente protocolo forneceu 24 derivados aminoquinolinoquinona com potencial atividade biológica.
Palavras chaves
Quinonas; quinolinoquinonas; aminoquinolinoquinona
Introdução
As quinolinoquinonas são moléculas que possuem em sua estrutura tanto a função quinolina quanto a função quinona. Dentre as quinolinoquinonas encontradas naturalmente, destacam-se a estreptonigrina e a lavendamicina, consideradas antibióticos antitumorais (KEYARI et al., 2013). De modo geral, os derivados 5,8-quinolinoquinonas tem despertado a atenção dos pesquisadores, devido a apresentarem uma extensa gama de atividades biológicas, tais como antitumoral, antibacteriana, antifúngica, anti-inflamatória e antimalárica (CHOI; CHI, 2004). A síntese de 5,8-quinolinoquinonas com substituintes na posição 6 e 7, tais como amino, hidroxi, metóxi, tiol e halogêneo vem sendo explorada, pois é conhecido na literatura que estes substituintes potencializam as suas atividades biológicas (Ryu et al., 2000). Uma comparação entre as atividades biológicas de uma série de derivados 6-alquilamino-5,8-quinolinoquinonas pode fornecer informações importantes da relação estrutura versus atividade biológica, fatores fundamentais para o desenvolvimento protótipos a novos compostos bioativos à base de quinolinoquinona.
Material e métodos
Durante a execução deste trabalho foram utilizados os seguintes reagentes e solventes: 8-hidroxiquinolina, bromo, ácido sulfúrico concentrado, ácido nítrico (61%), piperidina, pirrolidina, morfolina, tiomorfolina, 4-metilpiperazina, dietilamina, dipropilamina, n-butilamina, benzilamina, alilamina, 2-metoxietilamina, 2-hidroxietilamina, metanol, diclorometano, acetonitrila, n-hexano, acetato de etila. Nas análises de cromatografia em camada delgada analítica (CCDA) foram utilizadas placas de (2,0 X 4,0 cm) de sílica gel (F254 - Merck), visualizadas em luz ultravioleta (254 e 365 nm). Os produtos foram purificados em coluna cromatográfica utilizando gel de sílica 60 (230 - 400 mesh – Merck) na fase estacionária, e como eluente, uma mistura de solventes adequados. Os espectros de ressonância magnética nuclear de hidrogênio e de carbono (RMN de 1H e RMN de 13C) foram obtidos na Central Analítica do DQF-UFPE em aparelho Varian Unitty Plus 300 MHz ou Varian UNMRS 400 MHz. Os espectros na região do infravermelho (IV) foram obtidos em espectrofotômetro FT-IR–BOMEM MB-Series-100, utilizando pastilhas de brometo de potássio (KBr). Os experimentos de espectrometria de massas com ionização por “electrospray” foram realizados em um Waters Xevo GS-2 Q-TOF.
Resultado e discussão
Seguindo o procedimento de Choi e Chi (2004), o composto 7-bromo-5,8-quinolinoquinona (1) foi sintetizado em duas etapas reacionais. Inicialmente, a 8-hidroquinolina, reagiu com bromo em metanol a temperatura ambiente por 5 minutos, fornecendo, o 5,7-dibromo-8-hidroxiquinolina com 92% de rendimento. Em seguida, a 5,7-dibromo-8-hidroxiquinolina foi oxidada com uma mistura de ácido sulfúrico concentrado e ácido nítrico para obter a 7-bromo-5,8-quinolinoquinona (1) em 65% de rendimento. Os derivados aminoquinolinoquinonas (2a-l; 3a-l) foram obtidos a partir de uma aminação nucleofílica direta da 7-bromo-5,8-quinolinoquinona (1) em acetonitrila e temperatura ambiente. Através deste procedimento com diversas aminas secundárias foi possível obter os derivados 6-alquilamino-7-bromo-5,8-quinolinoquinonas (2a-g) com rendimento entre 38 e 57%, e os 6-alquilamino-5,8-quinolinoquinona (3a-g) entre 21 e 48%. Já as reações com aminas primárias produziram exclusivamente os alquilamino-7-bromo-5,8-quinolinoquinonas (2h-l) com bons rendimentos entre 62 e 80% (Tabela 1). Recentemente, Abdelwahab e colaboradores (2014) também mostraram que a aminação do 7-bromo-5,8-quinolinoquinona usando aminas primárias forma exclusivamente os análogos 6-alquilamino-7-bromo-5,8-quinolinoquinona. Analisando a proposta mecanística mostrada por Choi e Chi (2004), podemos compreender que a reação com aminas primárias favorece o intermediário enol, que rapidamente é oxidado para forma o produto bromado. Para minimizar a oxidação e direcionar a reação para formar o intermediário ceto, as reações com aminas primárias foram realizadas em atmosfera inerte de argônio por 12 horas. Através desta estratégia sintética foi possível obter os derivados 6-alquilamino-5,8- quinolinoquinonas (3h-l) a partir de aminas primárias com rendimento entre 34 e 51% (Tabela 2).
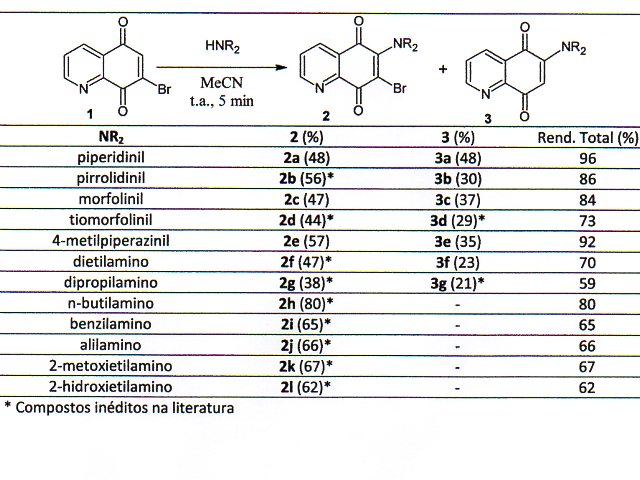
Derivados 6-alquilamino-5,8-quinolinoquinona
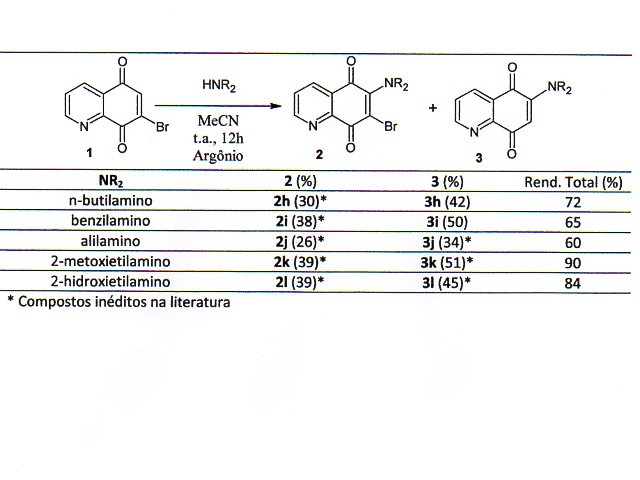
Derivados 6-alquilamino-5,8-quinolinoquinona
Conclusões
Através da aminação nucleofílica direta da 7-bromo-5,8-quinolinoquinona foram sintetizadas vinte quatro aminoquinolinoquinonas, entre estas, quatorze são inéditas na literatura. Uma nova estratégia sintética foi desenvolvida para a obtenção dos derivados 6-alquilamino-5,8- quinolinoquinonas (3h-l) a partir de aminas primárias.
Agradecimentos
Ao CNPq, FACEPE, CAPES, Central Analítica-DQF/UFPE, CENAPESQ/UFRPE.
Referências
ABDELWAHAB, A. B.; SHAABAN, M.; ISMAIL, M. A. H.; ABOUZID, K. A. M.; HANNA, A. G. Synthesis and cytotoxicity studies of some new amino isoquinolin-5,8-dione and quinolin-5,8-derivatives. Indian Journal of Chemistry, 2014, 53, 1098-1109.
CHOI, H. Y; CHI, D. Y. Simple preparation of 7-alkylamino-2-methylquinoline-5,8-diones: regiochemistry in nucleophilic substitution reactions of the 6- or 7-bromo-2-methylquinoline-5,8-dione with amines. Tetrahedron, 2004, 60, 4945-4951.
KEYARI, C. M.; KEARNS, A. K.; DUNCAN, N. S.; EICKHOLT, E. A.; ABBOTT, G.; BEALL, H. D.; DIAZ, P. Synthesis of new quinolinequinone derivatives and preliminary exploration of their cytotoxic properties. Journal of Medicinal Chemistry, 2013, 56, 3806-3819.
RYU, C.K.; KANG, H. Y.; YI, Y. J.; LEE, C. O. Cytotoxic activities of 6-arylamino-7-halo-5,8-quinolinediones against human tumor cell lines. Archives of Pharmacal Research, 2000, 23, 42-45.
































