Síntese do derivado tiazolidínico 5-(4-isopropilbenzidileno)tiazolidina-2,4-diona (Ju-925)
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
de Mendonça Moraes, R.K. (UFPE)
Resumo
Os compostos tiazolidínicos estão amplamente presentes na literatura representando um ramo bastante promissor de pesquisa na área farmacológica devido a sua excelente atividade biológica, o que justifica a síntese de novos derivados da série. Desse modo foi realizada a síntese do 5-(4- isopropilbenzidileno)tiazolidina-2,4-diona (Ju-925), por meio da condensação da tiazolidina-2,4-diona (Ju–32) com benzaldeído aromático, bem como a determinação das propriedades físicas do produto e os espectros de Ressonância Magnética Nuclear de Hidrogênio e Carbono treze para comprovação da estrutura química.
Palavras chaves
Tiazolidina; Tiazolidina-2,4-diona; tiazolidinona
Introdução
A produção de novas drogas com amplo espectro antimicrobiano é um forte aliado no combate à mortalidade em grupos de pessoas de diferentes idades ao redor do mundo. Neste contexto, há compostos derivados da tiazolidina descritos na literatura com excelentes resultados. (GOUVEIA et al., 2009). A tiazolidina-2,4-diona é o composto inicial no qual o ciclo tiazolidínico foi caracterizado mostrando as duas carbonilas nas posições 2 e 4 respectivamente. Este é um sistema de anel heterocíclico com múltiplas aplicações. As diversas atividades biológicas relacionadas com os seus análogos estruturais têm sido destacadas como antimicrobiana contra diversos tipos de bactérias Gram-positivas, Gram-negastivas, álcool-ácido resistentes como também antifúngicos. (ALEGAON e ALAGAWADI 2012), anticâncer (ROMAGNOLI et al., 2013), anti-inflamatória, analgésica (REANMONGKOL e SONGKRAM, 2013), anti-convulsivante (AMIN et al., 2008) entre outras. Derivados da tiazolidinadiona têm sido relatados como indutores de apoptose em linhagens de células cancerosas. Embora essas inibições de atividades farmacológicas citadas ainda não sejam satisfatórias, torna-se necessário ampliar as pesquisas buscando melhorar a propriedade inibitória contra diversas doenças. Isso pode ser feito colocando um ou mais grupos no anel arilideno de tiazolidinediona substituídas. Sua obtenção pode seguir diversos métodos segundo BROWN (1961), dentre os quais a reação de um ácido ou ésteres α- halogenados com os tiocarbamatos, os tiocianatos alcalinos ou a tioureia. Este trabalho teve o objetivo de sintetizar o composto 5-(4- isopropilbenzidileno) tiazolidina-2,4-diona (Ju-925) a partir da reação entre a tiazolidina-2,4-diona (Ju – 32) e o reagente 4-isopropilbenzaldeído (AM – 20), bem como determinar sua estrutura química.
Material e métodos
A um balão volumétrico de fundo redondo de 50 mL, sob agitação magnética e sem aquecimento, foram adicionados 0,2518 g (2,15x10-3mol) do reagente inicial, tiazolidina-2,4-diona (Ju – 32), os quais foram dissolvidos em 05 mL de etanol. Após a total solubilização do reagente inicial, foram adicionadas 03 gotas do catalisado (piperidina) para forrmação do ânion. O conjunto foi mantido sob agitação magnética por 15 minutos. Em seguida, foram acrescentados 0,25 mL (1,60x10-3mol) de 4-isopropilbenzaldeído (AM – 20). O balão foi mantido a temperatura ambiente, entretanto, devido a não interação entre os reagentes à temperatura inicialmente programada, o conjunto foi levado ao banho de óleo e teve a temperatura gradativamente ajustada, até que a interação teve início a 120°C. O processo reacional foi comprovado por cromatografia em camada delgada usando um sistema de solvestes apropriados. A reação ocorreu num sistema de refluxo do solvente e agitação magnética. Após a constatação do término da reação o conteúdo foi vertido em um béquer, o qual foi deixado sobre a bancada para que ocorresse a cristalização do produto. Durante esse processo de evaporação do solvente, os cristais foram se agrupando de modo a formarem películas finas em vários níveis do béquer. Os cristais formados apresentaram em forma de agulhas de cor branco. O produto obtido foi submetido à filtração a vácuo e lavados varias vezes com etanol, em seguida levado à estufa a 37°C para secagem. Após secagem foi determinada sua massa e esse foi posteriormente transferido a um frasco de penicilina, sendo devidamente etiquetado. Subsequentemente foram retiradas amostras para determinação de Rf, ponto de fusão e para realização do teste de solubilidade. Depois de atestada a pureza foi calculado o rendimento reacional.
Resultado e discussão
Para esta reação foram utilizadas quantidades equimolares dos reagentes, que
formou uma solução transparente logo que foram colocados em contatos um com
o outro. A reação aconteceu lentamente à temperatura ambiente, ou seja, não
houve gasto de água e nem de energia (necessária quando a reação se processa
sob refluxo). A não utilização desses dois itens deixa o processo mais
barato, tanto do ponto de vista econômico como para conservação do meio
ambiente. O ponto de fusão ocorreu na faixa 132 – 133,2 °C e os fatores de
retenção (Rf) obtidos foram determinados em dois sistemas apropriados para
ter certeza da pureza do produto diante da cromatografia de camada delgada
Rf=0,68 (Clorofórmio/Metanol–0,99:0,01) e o segundo em 0,46 (Hexano/Acetato
– 0,8:0,2) respectivamente. O teste de solubilidade teve como resultado a
frio os solvente seguintes: Tolueno, Cloreto de Metileno, THF, Acetato de
Etila, Clorofórmio, Dioxano, Etanol Acetona, DMSO e Metanol. Para
determinação da estrutura química foram realizados os espectros de
Ressonância Magnética Nuclear de Hidrogênio e Carbono treze como também o
espectro de Infravermelho e Massa. O espectro de Infravermelho foi
responsável pela identificação da função orgânica por meio das
características exatas e de absorções na faixa responsável por cada pico. Os
sinais referentes a cada hidrogênio e carbono foram identificados por meio
dos espectros de Ressonância Magnética Nuclear de Hidrogênio e de Carbono
treze. Os picos obtidos foram os seguintes: no Infravermelho (IV) (cm -1)
(KBr 1%) 3235; 13 3333,32 (CH3)2, (N–H); 1598,82 (C=N); 1287,31 (C-O). O
RMN1H e RMN13C (300 MHz, DMSO-d6, δ, ppm), mostraram cada hidrogênio
existentes na molécula como também seus deslocamentos químicos. O Massa
mostrou o Peso molecular exato além do pico base.
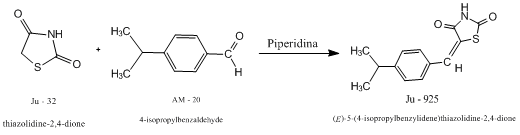
Esquema de Síntese do 5-(4- isopropilbenzidileno)tiazolidina-2,4-diona
Conclusões
O composto 5-(4-isopropilbenzidileno)tiazolidina-2,4-diona (Ju-925) foi sintetizado segundo os padrões reacionais estabelecidos na literatura para síntese de compostos tiazolidínicos. O rendimento obtido foi de 44 %, além de apresentar boa solubilização em uma ampla gama de solventes. A estrutura química foi determinada pelos métodos espectroscópicos de ressonância magnética nuclear de Hidrogênio, Carbono treze, Infravermelho e de massa. Também foram observadas as absorções do infravermelho para determinação dos grupos funcionais. O teste futuro será a determinação da atividade antimicrobiana.
Agradecimentos
Agradecimentos: Ao CNPq pelo financiamento da pesquisa. Ao Departamento de Química Fundamental da UFPE pelos espectros realizados.
Referências
ALEGAON, S. G., ALAGAWADI, K. R. New thiazolidine-2,4-diones as antimicrobialandcytotoxicagent. MedChem Res. 21: 3214–3223, 2012.
AMIN, K. M., RAHMAN, A. D. E., AL-ERYANI, Y. A. Synthesisandpreliminaryevaluationof some substitutedcoumarins as anticonvulsantagents. Bioorg. Med. Chem. 16: 5377- 5388, 2008.
BROWN, F.C. 4-Thiazolidinones. 1961. ChemicalReviews. 1961, 61: 464-471.
GOUVEIA, F. L., OLIVEIRA, R. M. B., OLIVEIRA, T. B., SILVA, I. M., NASCIMENTO, S. C., SENA, K. X. F. R., ALBUQUERQUE, J. F. C. Synthesis, antimicrobialandcytotoxicactivitiesof some 5- arylidene-4-thioxo-thiazolidine-2-ones. EuropeanJournalof Medicinal Chemistry. 44 (5): 2038–2043, 2009.
REANMONGKOL, W., SONGKRAM, C. In vivo anti-inflammatory, analgesicandantipyreticactivitiesof novel thiazolidine-2,4-dione analogsderivedfrom some classicalNSAIDs. Songklanakarin J. Sci. Technol. 35 (1): 33-40, 2013.
ROMAGNOLI, R, BARALDI, P. G., SALVADOR, M. K., CAMACHO, M. E., BALZARINI, J., BERMEJO, J., ESTÉVEZ, F. Anticanceractivityof novel hybridmoleculescontaining 5-benzylidene thiazolidine-2,4-dione. EuropeanJournalof Medicinal Chemistry. 63: 544-557, 2013.
































