Preparação de Dihidropirimidinonas derivadas do Álcool Propargílico
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Mass, E.B. (UFRGS) ; Russowsky, D. (UFRGS)
Resumo
Uma série de derivados 1,2,3-Triazólicos de Dihidropirimidinonas (DHPMs) foi sintetizada através da reação de cicloadição 1,3-dipolar Azida-Alcino catalizada por Cobre(I) entre 4-Aril-6-(2-Azidometil)-5-Etoxicarbonil- Dihidropirimidin-(1H)-2-onas e o Álcool Propargílico com rendimentos de 80-85%. As moléculas sintetizadas são inéditas e são potencialmente bioativas.
Palavras chaves
Dihidropirimidinona; Triazol; Álcool Propargílico
Introdução
As DHPMs são heterociclos nitrogenados sintetizados através da reação multicomponente de Biginelli. Esses compostos apresentam diversas atividades farmacológicas, tais como anticâncer, antioxidante e anti-inflamatória, e são considerados atraentes do ponto de vista da Química Medicinal (MATIAS et al.). A reação de formação de 1,2,3-Triazóis catalisada por Cobre (I) entre azidas e alcinos terminais se tornou um marco dentro do conceito de reações do tipo Click. Devido a sua confiabilidade, especificidade e biocompatibilidade, essas reações têm encontrado espaço em diversas áreas, como na química combinatorial, na proteômica e em reações de bioconjugação (AGALAVE et al., 2011). Os anéis 1,2,3-Triazólicos têm sido encontrados em diversos compostos com atividades biológicas, como atividades anticâncer, antioxidante e anti HIV (SARACI et al., 2017). Alguns desses compostos são derivados do Álcool Propargílico, como os obtidos por Jansa e colaboradores (2011), Pribut e colaboradores (2016) e Saraci e colaboradores (2017). Baseado nessas informações foi planejada a construção de DHPMs derivadas do Álcool Propargílico.
Material e métodos
Todos os reagentes usados nesse trabalho foram obtidos de fontes comerciais e foram utilizados sem prévia purificação, exceto o solvente Diclorometano, que foi destilado previamente ao uso. O acompanhamento das reações foi realizado por CCD. Primeiramente a reação de Biginelli foi realizada utilizando Ácido Acético como solvente e catalisador a 50 °C por 48 horas. Os produtos obtidos (4a-c) foram precipitados em Água, filtrados em funil de Büchner e lavados com solução saturada de NaHCO3 e Água. A azidação das Cloro-DHPMs (4a-c) com NaN3 foi realizada na mistura de solventes Acetona/Água a 60 °C por cerca de 3 horas. Os produtos (5a-c) foram isolados por decantação em água, filtrados em funil de Büchner e lavados com Água. Finalmente as Azido-DHPMs (5a-c) foram reagidas com o Álcool Propargílico (6) através da reação de cicloadição Azida-Alcino utilizando o sistema catalítico CuSO4.5H2O/Ascorbato de Sódio na mistura bifásica de solventes Diclorometano/Água, fornecendo os produtos 7a-c em até 2 horas. Todos os produtos sintetizados foram caracterizados por Ponto de Fusão, IV, RMN 1H e RMN 13C.
Resultado e discussão
A síntese dos produtos desejados ocorreu em três etapas, o esquema reacional
pode ser observado no Esquema 1. Inicialmente foi realizada a reação de
Biginelli utilizando Ureia (2), três diferentes Benzaldeídos
substituídos (3a, R = H; 3b, R = 3,4,5-(OMe)3;
3c, R = 4-Br) e o 4-Cloroacetoacetato de Etila (1) para formar
uma DHPM contendo um bom grupo de saída para a introdução do grupo azida na
etapa seguinte. As Cloro-DHPMs 4a-c foram obtidas em rendimentos
entre 67-72%. A azidação foi realizada sequencialmente, rendendo os
produtos 5a-c em 82-91%. A transformação foi confirmada através da
análise dos espectros de RMN 1H, RMN 13C e
Infravermelho. Nos espectros de IV, foi observado o aparecimento da banda de
estiramento antissimétrica da Azida perto de 2100 cm-1. Por fim, foi
realizado o acoplamento entre as Azido-DHPMs 5a-c e o Álcool
Propargílico 6 para a obtenção dos compostos desejados. Os produtos
7a-c foram isolados em rendimentos entre 80-85%. Na Figura 1 é
mostrado o espectro de RMN 1H do composto 7b, no qual
podem ser vistos todos os sinais esperados para o produto. Destaca-se o
singleto em 7,97 ppm, que confirma a formação do Triazol. Os dois singletos
em 9,58 e 7,84 ppm foram atribuídos aos hidrogênios amídicos da DHPM e o
dupleto em 4,51 ppm foi atribuído ao hidrogênio benzílico.
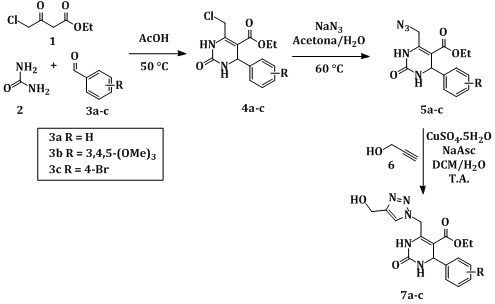
Rota sintética para obtenção das DHPMs derivadas do Álcool Propargílico.
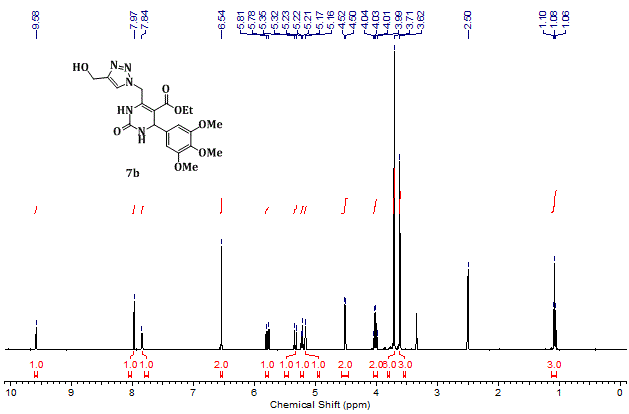
Espectro de RMN 1H (400 MHz, DMSO-d6) do composto 7b.
Conclusões
A metodologia empregada permitiu a síntese de três DHPMs inéditas derivadas do Álcool Propargílico em bons rendimentos (80-85%). Os produtos foram facilmente isolados e purificados e foram caracterizados por técnicas espectroscópicas usuais. Encontra-se em andamento a ampliação do escopo reacional, para que esses compostos tenham suas atividades biológicas avaliadas, visto que os fragmentos das moléculas sintetizadas já mostraram efeitos quando combinados com outros farmacóforos.
Agradecimentos
Os autores gostariam de agradecer à CAPES, à FAPERGS e ao CNPq pelo suporte financeiro.
Referências
AGALAVE, S. G.; MAUJAN, S. R.; PORE, V. S. Click Chemistry: 1,2,3-triazole as pharmacophore. Chemistry – An Asian Journal, V. 6, 1-23, 2011.
JANSA, P.; ŠPAČEK, P.; VOTRUBA, I.; BŘEHOVÁ, P.; DRAČÍNSKÝ, M.; KLEPETÁŘOVÁ, B.; JANEBA, S. Efficient one-pot synthesis of polysubstituted 6-[(1H-1,2,3-triazol-1-yl)methyl]uracils throufh the “click” protocol. Collection of Czechoslovak Chemical Communications, V. 76, 1121-1131, 2006.
MATIAS, M.; CAMPOS, G.; SANTOS, A. O.; FALCÃO, A. SILVESTRE, S.; ALVES, G. Potential antitumoral 3,4-dihydropyrimidin-2-(1H)- ones: synthesis, in vitro biological evaluation and QSAR studies. RSC Advances, V. 6, 84943-84958, 2016.
PRIBUT, N.; VEALE, C. G. L.; BASSON, A. E.; van OTTERLO, W. A. L.; PELLY, S. C. Application of the Huisgen cycloaddition and ‘click’ reaction toward various 1,2,3-triazoles as HIV non-nucleoside reverse transcriptase inhibitors. Bioorganic & Medicinal Chemistry Letters, V. 26, 3700-3704, 2016.
SARAEI, M.; GHASEMI, Z.; DEHGHAN, G.; HORMATI, M.; OJAGHI, K. Synthesis of some novel 1,2,3-triazole derivatives containing kojic acid moiety and evaluation for their antioxidant activity. Monatshefte für Chemie, V. 148, 917-923, 2017.
































