Identificação [i]in silico[/i] do alvo enzimático do ácido ursólico em [i]Leucoptera coffeella[/i]
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Oliveira, D.F. (UNIVERSIDADE FEDERAL DE LAVRAS)
Resumo
Verificou-se previamente que o ácido ursólico (1) inibia a oviposição de Leucoptera coffeella. Com vistas a contribuir para a obtenção de substâncias mais ativas, buscou-se identificar o alvo enzimático de 1 no inseto. Foi realizada uma busca farmacofórica por ligantes de enzimas com estruturas similares a de 1. A estrutura tridimensional da enzima selecionada não tinha insetos como origem. Logo, sua sequência foi utilizada em buscas por sequências de aminoácidos similares nos genomas de insetos, o que permitiu selecionar a glicogênio fosforilase (GF). Inibidores da GF e 1 foram ancorados nos sítios da GF. As afinidades de 1 pela enzima foram similares às obtidas para os inibidores, o que sugere que a enzima GF seja alvo do composto 1.
Palavras chaves
bicho mineiro do cafeeiro; glicogênio fosforilase; docking
Introdução
O Brasil é responsável por aproximadamente 25 % da produção mundial de café. Logo, a cafeicultura tem significativa importância socioeconômica para o país. Consequentemente, é essencial investir continuamente para solucionar problemas fitossanitários da cafeicultura brasileira, como é o caso do bicho mineiro do cafeeiro, Leucoptera coffeella Guérin-Mèneville, 1842 (Lepidoptera: Lyonetiidae) (Guerreiro-Filho, 2006). Este inseto pode reduzir a produção de café em 68-80% (Barrera, 2008). Os principais inseticidas utilizados no controle deste inseto são organofosforados, piretroides e carbamatos, que possuem um amplo espectro de ação e, em decorrência, causam desequilíbrios ambientais (Han et al., 2017). Tendo como objetivo contribuir para contornar este problema, em estudo previamente realizado foi observado que o ácido ursólico (1) inibia a oviposição de L. coffeella até níveis estatisticamente iguais aos observados para inseticidas comercialmente em uso. Com vistas a contribuir para a obtenção de substâncias com maiores atividades contra o inseto, este trabalho teve como objetivo geral identificar a enzima alvo do composto 1 através de métodos computacionais, para o uso futuro da mesma em planejamento racional da síntese de análogos/derivados de 1.
Material e métodos
O Composto 1 desprotonado foi submetido a buscas conformacionais com o programa computacional Open3Dalign 2.103 (Tosco et al., 2011). As conformações mais estáveis foram empregadas em busca farmacofórica com o programa Align-it 1.0.4 (Taminau et al., 2008), no banco de dados Ligand Expo (Feng et al., 2004). Na etapa seguinte, a sequência de aminoácidos da enzima glicogênio fosforilase (GF) (Wen et al., 2008), com escore de Tanimoto (Taminau et al., 2008) igual a 0,68, foi empregada em buscas por sequências de aminoácidos similares no banco de dados do National Center for Biotechnology Information-NCBI, utilizando o programa computacional Blastp 2.2.28+ (Altschul et al., 1997; Schäffer et al., 2001). Apenas as sequências nos genomas de insetos com cobertura e identidade maiores do que 90% e 36%, respectivamente, foram selecionadas. As enzimas GF 2QN1 e 2QN2 (Wen et al., 2008) foram alinhadas com o programa Swiss PDB Viewer 4.1.0 (Guex e Peitsch, 1997), para que seus arquivos pdb fossem convertidos ao formato pdbqt com o programa Autodock Tools 1.5.6 rc2 (Morris et al., 2009), que também foi utilizado para selecionar o grid box (29,25 x 29,25 x 29,25 Å) centrado no sítio de ligação original dos ácidos asiático (2) e maslínico (3). Em seguida, as conformações mais estáveis dos compostos 1-3 desprotonados (as conformações de 2 e 3 também foram obtidas com o uso do programa Open3Dalign) foram convertidas ao formato pdbqt com o programa Autodock Tools, para serem ancoradas nas enzimas GF com o programa computacional Autodock Vina 1.1.2 (Trott e Olson, 2010). A exceção do parâmetro exhaustiveness, que foi elevado para 128, os outros foram utilizados com seus valores padrões.
Resultado e discussão
Apenas a enzima GF, com escore de Tanimoto 0,68, foi selecionada após a busca farmacofórica, pois todas as outras apresentaram valores abaixo de 0,5 para o referido escore. A enzima GF é de vital importância para insetos, pois catalisa a hidrólise de glicogênio para formar glicose-1-fosfato (Tang et al., 2012). Como não havia qualquer estrutura tridimensional descrita para GF produzida por insetos, as sequências de aminoácidos das GF 2QN1 e 2QN2 foram utilizadas em buscas nos genomas de insetos, o que permitiu identificar 43 sequências de aminoácidos. Especificamente para a ordem Lepidoptera, as similaridades foram todas acima de 80%, sugerindo que 2QN1 e 2QN2 podiam ser utilizadas como modelos iniciais para o estudo da GF de L. coffeella.
Como os compostos 2 e 3 podiam inibir 2QN1 e 2QN2 através de complexação a um sítio alostérico, ao qual o ativador AMP se liga (Wen et al., 2008), este foi o local de ancoramento escolhido para este trabalho. Os compostos 2 e 3 apresentaram muita afinidade pela enzima, o que parece razoável, já que estavam nos cristais das GF 2QN1 e 2QN2, que foram utilizados para obter experimentalmente as estruturas tridimensionais destas enzimas. Estes compostos estavam localizados nos sítios alostéricos de 2QN1 e 2QN2, o que deve ter feito com que tais sítios ficassem mais adequados a 2 e 3. Apesar disto, 1 apresentou mais afinidade pela GF do que os compostos 2 e 3 (Figura 2), sugerindo que 1 seja um inibidor da GF. Embora uma ligação de hidrogênio tenha sido formada entre o grupo OH de 1 e o resíduo de aminoácido Ser317 (cadeia A), a maior parte das interações deste composto com a enzima ocorreram através de grupos apolares.
Estruturas químicas dos ácidos ursólico, asiático e maslínico.
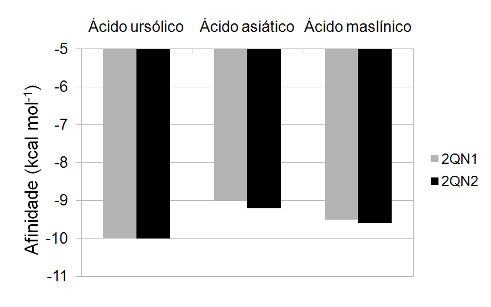
Afinidades dos ácidos ursólico, asiático e maslínico pelas glicogênio fosforilases 2QN1 e 2QN2.
Conclusões
De acordo com os cálculos computacionais realizados, o ácido ursólico (1) se liga à GF de L. coffeella, o que sugere que esta enzima possa ser utilizada no planejamento racional de derivados/análogos de 1 mais ativos contra o inseto.
Agradecimentos
FAPEMIG, CAPES e CNPq.
Referências
Altschul, S. F.; Madden, T. L.; Schäffer, A. A.; Zhang, J.; Zhang. Z.; Miller, W.; Lipman, D. J.; [i]Nucleic Acids Res.[/i] [b]1997[/b], 25, 3389.
Barrera J. F.; [i]Encyclopedia of Entomology[i]; Capinera, J. L., ed., Springer: Netherlands, [b]2008[/b], cap 11.
Feng, Z.; Chen, L.; Maddula, H.; Akcan, O.; Oughtred, R.; Berman, H. M.; Westbrook, J.; [i]Bioinformatics[/i] [b]2004[/b], 20, 2153.
Guerreiro-Filho O.; [i]Braz. J. Plant Physiol.[/i] [b]2006[/b], 18, 109.
Guex, N.; Peitsch, M. C.; [i]Electrophoresis[/i], [b]1997[/b], 18, 2714.
Han, Y.; Mo, R.; Yuan X.; Zhong, D.; Tang, F.; Ye, C.; Liu, Y.; [i]Chemosphere[i] [b]2017[/b], 180, 42.
Morris, G. M.; Huey, R.; Lindstrom, W.; Sanner, M. F.; Belew, R. K.; Goodsell, D. S.; Olson, A. J.; [i]J. Comput. Chem.[/i] [b]2009[/b], 30, 2785.
Taminau, J.; Thijs, G.; De Winter, H.; [i]J. Mol. Graphics Modell.[i] [b]2008[/b], 27, 161.
Tang, B.; Xu, Q.; Zou, Q.; Fang, Q.; Wang, S.; Ye, G.; [i]Arch. Insect Biochem. Physiol.[/i] [b]2012[/b], 80, 42.
Tosco, P.; Balle, T.; Shiri, F.; [i]J. Comput.-Aided Mol. Des.[/i] [b]2011[/b], 25, 777.
Trott, O.; Olson, A. J.; [i]J. Comput. Chem.[/i] [b]2010[/b], 31, 455.
Wen, X.; Sun, H.; Liu, J.; Cheng, K.; Zhang, P.; Zhang, L.; Hao, J.; Zhang, L.; Ni, P.; Zographos, S.E.; Leonidas, D. D.; Alexacou, K. M.; Gimisis, T.; Hayes, J. M.; Oikonomakos, N. G.; [i]J. Med. Chem.[/i] [b]2008[/b], 51, 3540.
































