Derivados da Isatina: Síntese, Caracterização e Atividade Anti-Câncer.
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Silva, G.C. (UFPE) ; Barbosa, M.O. (UFPE) ; Siqueira, L.R.P. (UFPE) ; Gomes, P.A.T.M. (UFPE) ; Santos, I.R. (UFPE) ; Conceição, J.M. (UFPE) ; Carvalho, L.V.N. (UFPE) ; Dias, M.C.H.B. (UFPE) ; Rego, M.J.B.M. (UFPE) ; Leite, A.C.L. (UFPE)
Resumo
A identificação e utilização de estruturas privilegiadas como base para a obtenção de novas moléculas, têm se destacado na química medicina. Como exemplo de estruturas privilegiadas temos o heterocíclico isatina. Fazendo uso da estratégia de hibridização molecular foram obtidos compostos isatina- tiossemicarbazona. O trabalho apresenta o planejamento, síntese e caracterização estrutural de nove inéditos derivados da isatina, assim como resultados das atividades antitumorais. Nenhum dos compostos apresentou citotoxicidade na dose de 100 μM para células normais humanas. Os resultados preliminares indicam que três compostos revelaram importante atividade antineoplásica, o que pode indicar que a otimização estrutural destes pode ser promissora para a obtenção de novos agentes antineoplásicos.
Palavras chaves
Câncer; Isatinas; Tiossemicarbazonas
Introdução
O câncer, termo genérico para um grande grupo de doenças, é um conjunto de células que possui a proliferação desordenada e a incapacidade de diferenciação celular normal como características em comum. A doença é uma das principais causas de morbi-motalidade em todo o mundo e foi responsável pela morte de 8,8 milhões de pessoas em 2015 (WHO, 2015). A quimioterapia disponível para o tratamento do câncer apresenta vários problemas quanto à especificidade e potencialidade, além do agravante do desenvolvimento de resistência a múltiplos medicamentos (SHUKLA et al., 2012). Um conhecido grupo farmacofórico que apresenta uma notável e conhecida atividade antiproliferativa contra várias linhagens de células cancerosas é o heterociclo isatina (ABOUL-FADL et al., 2012). A aprovação pela FDA do oxindol, malato de sunitinibe, como um inibidor de quinase para o tratamento do carcinoma renal avançado e tumores estromais gastrointestinais, destacou, ainda mais, o crescente interesse em isatinas como uma nova classe de agentes antineopláscos. (MOTZER et al., 2006). Além da potente inibição de quinase, o mecanismo de ação de outros derivados da isatina inclui a inibição e/ou modulação de proteases, inibição da tradução, da neovascularização e da polimerização da tubulina (VINE et al., 2009; Abadi et al. 2006). Assim, o presente trabalho tem como o objetivo a síntese, elucidação espectroscópica e avaliação biológica de novos derivados isatínicos com possível atividade antitumoral.
Material e métodos
Neste trabalho reagiu derivados da isatina com a tiossemicarbazida e obteve tiossemicarbazonas com altos rendimentos. A síntese é realizada em solução etanólica, sob refluxo, na presença de catalisador ácido conforme metodologia de KARAH (2002). Tendo como base a metodologia acima, foram obtidos os nove compostos (LpQM-Int1 a 9) reagindo-se três diferentes isatinas, com três diferentes tiossemicarbazidas, ambas obtidas comercialmente. O tempo de reação foi de três horas e os rendimentos foram de 60 à 85%. Os compostos foram elucidados através de infravermelho e Ressonância Magnética Nuclear 1H e 13C. Para a avaliação biológica, as linhagens celulares foram em cultura, a 37ºC e 5% de CO2 e acompanhadas diariamente com o auxílio de um microscópio invertido. As linhagens aderentes T47D e HeLA foram obtidas pelo banco de células do Rio de Janeiro (BCRJ) e ATCC (American Type Culture Collection). As linhagens hematopoiéticas K562 e HL-60mx1 foram obtidas pelo BCRJ. As células foram plaqueadas em placas de 96 poços e cada poço recebeu a quantidade de 1.104 de células. Após 24h diferentes concentrações dos compostos foram adicionadas e as placas incubadas em estufa úmida a 37ºC e 5% de CO2 por 72h. Passado o período de incubação foi adicionado 20 µL da solução de MTT na concentração de 5 g/mL diluída em PBS, as placas foram então protegidas da luz e incubadas mais uma vez em estufa úmida a 37ºC e 5% de CO2 por um período de 3h. A reação foi então interrompida pela adição de 130 µL de SDS 20% e a densidade óptica medida após 24 horas no comprimento de onda de 560 nm. A leitura foi realizada em um leitor de microplacas (EL808 - Biotek®). A determinação do potencial citotóxico dos compostos testados foi calculada em relação ao controle tratado com o veículo DMSO a 0,01%.
Resultado e discussão
Neste trabalho reagiu-se derivados da isatina com a tiossemicarbazida e
obteve tiossemicarbazonas com altos rendimentos (Figura 1). Os compostos
foram elucidados através de infravermelho, Ressonância Magnética Nuclear 1H
e 13C e espectroscopia de massas.As moléculas da série LpQM-Int1 a LpQM-Int-
9 foram avaliados quanto à toxicidade frente a células humanas mononucleares
do sangue periférico (PBMCs). Como pode ser observado na Figura 2 onde todos
os compostos não apresentaram toxicidade mesmo na dose máxima testada (100
µM). Os compostos foram testados em quatro linhagens de células tumorais,
duas linhagens de células aderentes, T-47D (Carcinoma ductal de mama) e
HeLa (Adenocarcinoma cervical), e duas linhagens em suspensão, HL-60/mx1
(Leucemia aguda resistente a Etoposideo, Teniposideo e Bisantreno) e K-562
(Leucemia mielóide crônica), em única dose de 10 μM.
Os resultados, apresentam um prévio padrão de relação entre a estrutura dos
compostos e a atividade apresentada até o momento. Os compostos LpQM-Int4,
LpQM-Int5 e LpQM-Int6 provocaram uma considerável redução da viabilidade
celular das linhagens tumorais testadas, inclusive na linhagem que apresenta
resistência a múltiplas drogas (HL-60/mx1). O composto LpQM-Int6, que
apresenta, além do grupo fenil no nitrogênio, um cloro em C5 no grupo
isatina, reduziu a viabilidade celular das quatro linhagens de cânceres
testados. Esse resultado pode reforçar a importância da presença de
halogênios nessa posição em isatinas, como já relatado na literatura (VINE
et al., 2007; VINE et al., 2009).
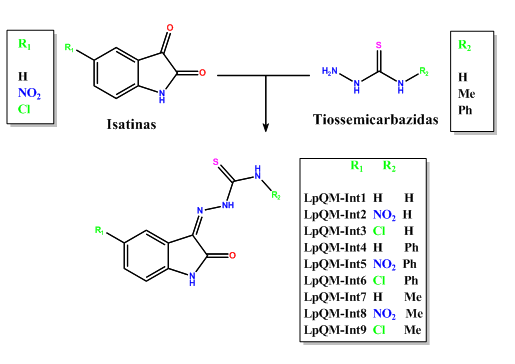
Figura 1. Rota de síntese dos compostos.
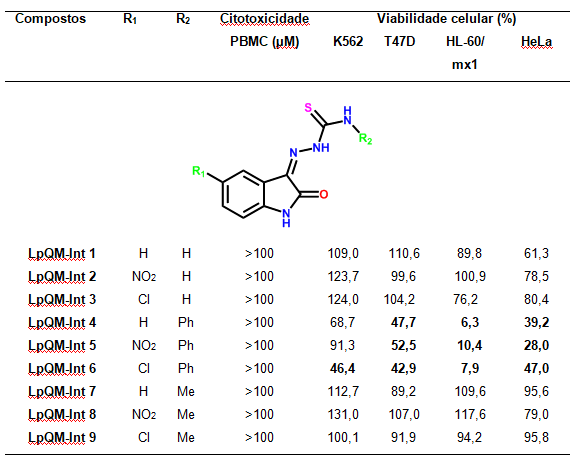
Figura 2. Valores de citotoxicidade dos compostos e viabilidade celular.
Conclusões
Foram obtidos nove derivados do núcleo isatina-tiossemicarbazonas cujas estruturas foram elucidadas pelas técnicas de RMN de H1 e C13, IV e espectroscopia de massas. A maioria dos compostos não apresentou toxicidade frente a células normais humanas, na dose máxima testada (100 μM). Com relação às propriedades antitumoral, resultados preliminares indicam que a presença de um fenil em N3 nas tiossemicarbazonas LpQM-Int4, LpQM-Int5 e LpQM-Int6 é importante para a atividade antitumoral.
Agradecimentos
CNPq, CAPES, FACEPE, UFPE, Central Analítica, LpQM e LINAT.
Referências
ABOUL-FADL, T.; RADWAN, A. A.; ATTIA, M. I.; AL-DHFYAN, A.; ABDEL-AZIZ, H. A. Schiff bases of indoline-2,3-dione (isatin) with potential antiproliferative activity. Chemistry Central Journal, v. 6, p. 49, 2012.
KARAH, N. Synthesis and primary cytotoxicity evaluation of new 5-nitroindole-2,3-dione derivatives. Eur. J. Med. Chem. v. 37, p. 909-918, 2002.
MOTZER, R. J.; MICHAELSON, M. D.; REDMAN, B. G.; HUDES, G. R.; WILDING, G.; FIGLIN, R. A.; GINSBERG, M. S.; KIM, S. T.; BAUM, C. M.; DEPRIMO, S. E.; LI, J. Z.; BELLO, C. L.; THEUER, C. P.; GEORGE, D. J.; RINI, B. I. Activity of SU11248, a multitargeted inhibitor of vascular endothelial growth factor receptor and platelet-derived growth factor receptor, in patients with metastatic renal cell carcinoma. J. Clin. Oncol., v. 24, p. 16–24, 2006.
SHUKLA, S.; SRIVASTAVA, R. S.; SHRIVASTAVA, S. K.; SODHI, A.; KUMAR, P. Synthesis, Molecular docking and Biological evaluation of 4-Cycloalkylidineamino 1, 2-Naphthoquinone Semicarbazones as Anticancer agents. Asian Pacific Journal of Tropical Biomedicine. p. S1040-S1046, 2012.
VINE, K. L.; LOCKE, J. M.; RANSON, M.; PYNE, S. G.; BREMNER, J. B.; Bioorg. Med. Chem. 2007, 15, 931;
VINE, K. L., MATESIC, L., LOCKE, J. M., RANSON, M., SKROPETA, D. Cytotoxic and Anticancer Activities of Isatin and Its Derivatives: A Comprehensive Review from 2000-2008. Anti-Cancer Agents in Medicinal Chemistry, 9, 397-414. 2009.
WHO. Cancer (fact sheets). Disponível em: <http://www.who.int/mediacentre/factsheets/fs297 /en/>. Acesso em: 06 de Agosto de 2017.
































