Regioseletividade na Síntese de 3-fenil-2-(piridin-2-ilimino)-tiazolidin-4-ona via Ciclização Intramolecular de Tioureia Assimétrica
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Pintos, T. (UFPEL) ; Campos, J. (UFPEL) ; Siqueira, G. (UFPEL)
Resumo
O anel tiazolidinona apresentam um papel importante no desenvolvimento de novos protótipos devido a associação com atividades biológicas difundidas na literatura como: antimicrobiana, antiviral, anti-inflamatória, anticâncerígena,antidiabetes etc. Por isso, esse trabalho objetivou a síntese de 3-fenil-2-(piridin-2-ilimino)-tiazolidin-4-ona envolvendo a ciclização de ácido cloroacético com isotiocianato de fenila em refluxo por 16h para futuros testes biológicos. O produto obtido, após a recristalização, apresentou forma de cristais brancos, que por sua vez, foram caracterizados via análises espectrométricas e por difração de raio-x. Por fim, a importância dessa síntese em outras estratégias de obtenção de 2- imino-tiazolidin-4-onas devido a sua regioselitividade obervada pelas análises.
Palavras chaves
Iminotiazolidinona; Regioseletividade; Tioureia
Introdução
Um dos principais objetivos da química orgânica e da química medicinal é a busca de novas moléculas capazes de tornarem-se futuros agentes terapêuticos. Existem inúmeras moléculas biologicamente ativas contendo anéis de cinco membros com dois heteroátomos, dentre essas, as que possuem o anel tiazolidinona apresentam um papel importante no desenvolvimento de novos protótipos devido a associação com atividades biológicas difundidas na literatura como: antimicrobiana, antiviral, anti-inflamatória, anticancerígenas, antidiabetes dentre outras. Dentre as tiazolidinonas, as que contem uma carbonila na posição 4 são as que mais despertam interesse em química medicinal nos últimos anos (TRIPATHI et al, 2014) . Na mesma proporção, vem crescendo o número de trabalhos referente as 2-imino-4- tiazolidinonas. Há duas metodologias de síntese de 2-imino-4-tiazolidinonas que são amplamente difundidas na literatura. As duas rotas sintéticas mais destacadas são as que envolvem a ciclização de tioureias com derivados de ácidos α-haloacéticos, e a outra, que envolve a ciclização de α- haloacetamidas com isotiocianatos ou tiocianatos (CAI et al, 2016). Na primeira rota, objeto desse trabalho, LAURENT et al, 2004 sugerem que o substituinte o qual possui um heteroátomo protonado (via meio ácido) promove o ataque na carbonila do nitrogênio próximo a ele (Esquema 1). O presente trabalho tem como objetivo sintetizar, identificar e caracterizar a regioseletividade na formação de 3-fenil-2-(piridin-2-ilimino)-tiazolidin-4- ona utilizando tioureia assimétrica derivada da 2-aminopiridina.
Material e métodos
- Síntese de Tioureia Assimétrica 3 Num balão de fundo redondo de 50 mL foram adicionados 5 mmol de 2- aminopiridina, em seguida, foi adicionado 25 mL de diclorometano até solubilizar completamente a amina, logo após, foi adicionado 5,1 mmol de fenilisotiocianato. A mistura, então, foi mantida sob agitação e refluxo por 3 horas, tempo esse alcançado, após o desaparecimento da amina na análise de cromatografia de camada delgada (CCD) utilizando diclorometano como eluente. Por fim, resfriou-se a mistura e removeu-se o solvente com evaporador rotativo e o sólido residual foi recristalizado com etanol filtrando em funil sinterizado previamente pesado. Após a secagem do funil pesou-se os cristais filtrados e calculou-se o rendimento. Parte da amostra foi destinada para analises de cromatografia gasosa acoplada a espectrômetro de massas (CG/EM) para identificar e verificar a pureza do produto. - Síntese de 3-fenil-2-(piridin-2-ilimino)-tiazolidin-4-ona 4 Num balão de fundo redondo de 50 mL foram adicionados 3 mmol de tioureia assimétrica, 6 mmol de ácido cloroacético e 25 mL de etanol como solvente. A mistura, então, foi mantida sob agitação e refluxo por 16 horas, tempo esse alcançado, após o desaparecimento da tioureia na análise de CCD utilizando diclorometano como eluente. Por fim, resfriou-se a mistura, transferiu-se para um bequer e levou-se ao refrigerador por um dia até completa cristalização. Após isso, filtrou-se o sólido cristalizado em funil sinterizado previamente pesado, secou-se e pesou-se o sólido calculando o rendimento. Parte da amostra foi destinada para analises de CG/EM, ressonância magnética nuclear de 13C e 1H (RMN) e difração de raio-x.
Resultado e discussão
A pureza do produto foi verificada por meio de cromatografia gasosa acoplada
a espectroscopia de massas, o qual o cromatograma revelou um pico com
proporção de áreas igual a 98% e o íon molecular m/z 269•+. O espectro de
RMN 1H (600 MHz, CDCl3) apresentou sinais do grupamento (CH2 – Anel
Tiazolidínico) com deslocamento químico em 3,88 ppm, forte singleto (s) e os
demais (CH – Aromáticos) em duas faixas de deslocamento: 6,98 – 7,91 ppm,
multipletos (m) e um deslocamento de 8,43 ppm, dubleto (d) com constante de
acoplamento J = 4,94 Hz referente ao CH ligado diretamente ao nitrogênio da
piridina. Já, o espectro de RMN 13C (150 MHz, CDCl3) apresentou 12
deslocamentos químicos referentes aos 14 carbonos da substância, destacando
os carbonos: (CH2, C=O e C=N – Anel Tiazolidínico) com deslocamentos de
33,52 ppm, 171,94 ppm e 158,34 ppm, respectivamente, e os demais carbonos
(aromáticos) dentro da faixa de 120 – 158 ppm. Contudo para elucidar a
posição exata tanto da porção piridínica quanto da fenilíca da substância 4
realizou-se a análise de difração de raio-x dos cristais brancos obtidos e
se confirmou que a porção piridínica está ligada ao nitrogênio da amida do
anel tiazolidínico (Diagrama 1). Diferentemente da síntese realizada por
LAURENT et al, 2004, o qual foi realizada via bromoacetato de etila em meio
ácido, nesse trabalho foi utilizado ácido cloroacético em excesso no intuito
de se manter o meio ácido, além de ser o agente responsável pela ciclização
da tioureia. Àquele trabalho obteve-se somente traços desse composto,
todavia dessa forma obteve-se um rendimento moderado de 55% de cristais
puros. Acredita-se que a combinação de excesso de ácido cloroacético em
relação a tioureia (proporção 1:2) favoreceu a regioselitividade (Esquema
1).
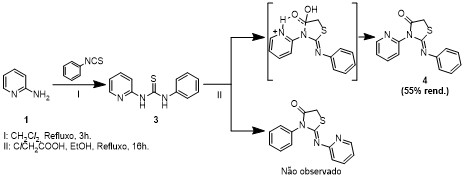
Síntese de 3-fenil-2-(piridin-2-ilimino)- tiazolidin-4-ona.
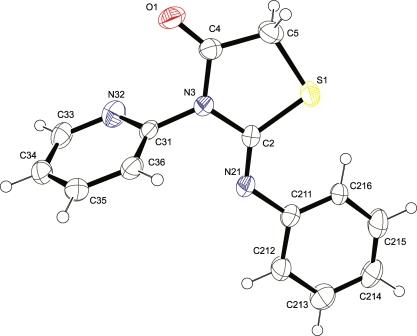
Diagrama ORTEP de 3-fenil-2-(piridin-2-ilimino)- tiazolidin-4-ona.
Conclusões
A síntese da substância 3-fenil-2-(piridin-2-ilimino)-tiazolidin-4-ona 4, como demonstrado, foi possível de ser realizada com rendimento moderado de 55%, com pureza elevada comprovada tanto por CG/EM quanto por RMN, inclusive sem a presença do possível isômero, porém a caracterização necessitou dos dados da análise de raio-x para elucidação da localização exata dos constituintes, além disso, essa síntese poderá ser utilizada com outras tioureias assimétricas quando não ocorrer com outros derivados de ácidos α-haloacéticos.
Agradecimentos
A UFPEL, ao LAQUIABIO/UFPEL e ao NUQUINHE/UFSM pelas análises de RMN e Raio-X.
Referências
CAI, M. G.; WU, Y.; CHANG, J. Synthesis and biological evaluation of 2-arylimino-3-pyridin-thiazolineone derivatives as antibacterial agents. Bioorganic and Medicinal Chemistry Letters, v. 26, n. 10, p. 2517–2520, 2016.
ST. LAURENT, D. R.; GAO, Q.; WU, D.; SERRANO-WU, M. H. Regioselective synthesis of 3-(heteroaryl)-iminothiazolidin-4-ones. Tetrahedron Letters, v. 45, n. 9, p. 1907–1910, 2004.
TRIPATHI, A. C.; GUPTA, S. J.; FATIMA, G. N.; SONAR, P. K.; VERMA, A.; SARAF, S. K. 4-Thiazolidinones: The advances continue. European Journal of Medicinal Chemistry, v. 72, p. 52–77, 2014.
































