Síntese e Caracterização do (2S)-1-[2-Metilpropanoil] pirrolidina-2 carboxilico: Impureza E do Fármaco Captopril
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Machado, I.V. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Vidal, H.D.A. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Lemes, (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Queiroz, J.E. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Awad, R. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Aquino, G.L.B. (UNIVERSIDADE ESTADUAL DE GOIÁS)
Resumo
O (2S)-1-[2-Metilpropanoil] pirrolidina-2-carboxilico, denominado Impureza E, é umas das impurezas do captopril. Essa impureza é utilizada em indústrias farmacêuticas como padrão para realizar estudos de estabilidade, sua síntese pode ser através da amidação de um cloreto de acila. A síntese de derivados de cloreto de ácido, geralmente, exige um longo tempo reacional e processos de separação complexos, o uso de aquecimento via micro-ondas na reação de preparo do derivado do cloreto de ácido a partir do ácido isobutírico foi realizado na ausência de solventes e sem a formação de subprodutos. Este produto foi utilizado na síntese da impureza E. Desta forma, a impureza E foi obtida em sua forma cristalina com 89% de rendimento, sendo analisado por: IV, MEV, TGA, 1H RMN e 13C RMN.
Palavras chaves
Impureza E; Micro-ondas; Degradação
Introdução
O fármaco captopril (ácido (2S)-1-[(2S)-2-metil-3-sulfanilpropanoil] pirrolidino-2-carboxílico) está incluído na classe terapêutica dos anti- hipertensivos (“Departamento de Informática do SUS”, [s.d.]). Os fármacos após disponíveis para consumo podem apresentar impurezas, que de acordo com a ANVISA são alterações químicas que podem ser decorrentes de sua fabricação ou até mesmo do armazenamento, essas impurezas são denominados produtos de degradação (ANVISA, 2015). Se tratando do captopril, um dos produtos de degradação que a molécula pode gerar é o (2S)-1-[2- Metilpropanoil] pirrolidina-2-carboxilico, conhecido como impureza E do captopril. Para a produção de tal impureza, uma das possibilidades é a reação de amidação de um cloreto de acila, em que este pode ser obtido através de uma síntese via micro-ondas, que se torna mais viável, pois são relativamente mais rápidas quando comparadas com método convencional devido a capacidade de superaquecer (DEOKATE; GORDE, 2014). O aquecimento por micro-ondas é mais efetivo devido a penetração limitada de ondas na amostra, pois na medida que as ondas entram em contato com o material liberam energia na forma de calor, consequentemente, o aumento de temperatura se dá do interior para as laterais do meio reacional, enquanto que no aquecimento convencional, ocorre um gradiente de temperatura (LÜHKEN; BADER, [s.d.]). Outra vantagem é que reações via micro-ondas são consideradas como uma abordagem em química verde, pois além de reduzir o tempo reacional, reduzem o uso de solventes ou não os utilizam e diminuem as reações secundárias aumentando o rendimento e a pureza do produto desejado (AMETA et al., 2014). Desta forma, objetiva-se sintetizar a impureza E do captopril por aquecimento via por micro-ondas com posterior caracterização.
Material e métodos
A síntese da impureza E do captopril foi realizada em 2 etapas, onde a primeira etapa optou-se por realizar uma síntese via micro-ondas, pois conforme descrito na literatura as reações para obtenção de cloreto de ácido exigem muito tempo, além de empregar solventes e catalizadores aumentando o custo reacional (MONSON, 1971; OLIVEIRA, 2005; SHIMAZAKI et al., 1982). Para síntese do devido cloreto de ácido, incialmente adicionou-se ácido isobutírico e cloreto de tionila (1:2) em um balão de fundo redondo e colocou-se para reagir via micro-ondas sob sistema aberto a uma temperatura de 80ºC, 200W, por ciclos de 2 minutos. O produto foi destilado em um destilador horizontal à 70ºC, 30rpm e 500mbar. Na segunda etapa dissolveu-se L-prolina em solução aquosa de NaOH 2M e resfriou a solução para aproximadamente 0ºC, em banho de gelo. Adicionou-se o equivalente em mols de cloreto de ácido (1:1) e deixou-se a solução sob agitação durante 1h em banho de gelo e NaCl para manter a temperatura baixa. Logo após a solução foi mantida em repouso por 1h para atingir a temperatura ambiente. A reação foi acompanhada por TLC, fase móvel: acetato de etila, etanol, água (5:1:1) e revelada com ninhidrina 2% em butanol. A solução foi acidificada com HCl 6M até alcançar o pH 1 e então realizou a extração com 3 volumes de 30mL de acetato de etila, lavou-se a fase orgânica com 10mL de solução saturada de NaCl e secou-se com sulfato de sódio anidro. A fase orgânica foi concentrada por rota evaporação e o resíduo solido obtido foi cristalizado em uma mistura de acetato de etila e hexano (1:1). O produto foi analisado por IV, 1H RMN, 13C RMN, TGA e MEV.
Resultado e discussão
Após o término da segunda etapa apenas um produto foi detectado por TLC com
fator de retenção de 0,5. O rendimento final da reação apresentou um
resultado satisfatório, sendo este igual à 89%. A caracterização do composto
foi realizada por: infravermelho, microscopia eletrônica de varredura (MEV),
análise termogravimétrica (TGA) e ressonância magnética nuclear (1H RMN e
13C RMN).
As análises de infravermelho e RMN foram estudadas e comparadas com
resultados já descritos na literatura, consequentemente, foi possível
comprovar que houve a formação do produto desejado e com pureza
satisfatória. É importante salientar que os resultados foram comparados com
o certificado de análise da impureza comercial que é fornecida pela LGC
(“LGC Reference Standards”, [s.d.]).
Através da análise realizada por microscopia eletrônica de varredura foi
possível afirmar que o produto foi obtido na sua forma cristalina.
A análise termogravimétrica mostrou que em atmosfera inerte de nitrogênio o
composto possui maior estabilidade quando comparada com a estabilidade
frente a atmosfera de oxigênio. Pois através da derivada foi possível
observar que o composto em atmosfera de nitrogênio apresentou maior pico de
perda de massa em aproximadamente 250ºC, sendo que nessa temperatura havia
cerca de 40% da massa analisada do produto (Figura 1), enquanto que frente
ao oxigênio a amostra apresentou o maior pico de perda de massa em torno de
245°C, e nessa temperatura a massa restante do produto era equivalente a
apenas 20% da massa total analisada (Figura 2).
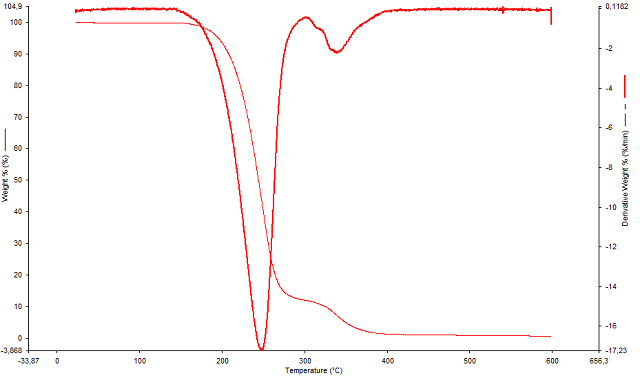
Análise de TGA frente a atmosfera de nitrogênio.
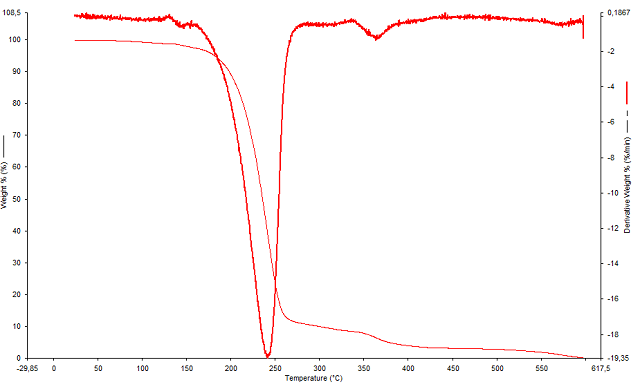
Análise de TGA frente a atmosfera de oxigênio.
Conclusões
A síntese da impureza E foi realizada apresentando um resultado satisfatório, a formação do intermediário via micro-ondas mostrou-se uma metodologia eficiente ainda mais se tratando de reação que requerem muito tempo, isso significa que o uso de micro-ondas pode ser disseminado auxiliando no progresso da ciência. A impureza E foi obtida com sucesso com rendimento de 89% e a caracterização comprovando a elucidação estrutural.
Agradecimentos
A Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo apoio financeiro concedido para realização do trabalho, Universidade Estadual de Goiás e a
Referências
AMETA, S. C.; PUNJABI, P. B.; AMETA, R.; AMETA, C. Microwave-assisted Organic Synthesis: A Green Chemical Approach. [s.l: s.n.].
ANVISA. Resolução De Diretoria Colegiada - RDC No 53, De 04 De Dezembro De 2015. Diário Oficial da União, 2015.
DEOKATE, U.; GORDE, A. M. Forced degradation and stability testing: Strategies and analytical perspectives. International Journal of Pharmaceutical Sciences Review and Research, v. 26, n. 2, p. 242–250, 2014.
Departamento de Informática do SUS. Disponível em: <http://hiperdia.datasus.gov.br/medicamentosdesc.asp?med=captopril>. Acesso em: 1 ago. 2017.
LGC Reference Standards. Disponível em: <https://hybris-static-assets-production.s3-eu-west-1.amazonaws.com/sys-master/pdfs/hba/h23/9344212992030/en_ST-WB-CERT-2050075-1-1-1.PDF>. Acesso em: 20 jul. 2017.
LÜHKEN, A.; BADER, H. J. Energy input from microwaves and ultrasound – examples of new approaches to green chemistry. Disponível em: <http://www.scheikundeinbedrijf.nl/content/Modules/Modulenaam/Files/microwaves.pdf>. Acesso em: 27 maio. 2017.
MONSON, R. S. Advanced Organic Synthesis. Methods and Techniques. Hayward, California: Academic Press, 1971.
OLIVEIRA, C. DE. Síntese de Compostos Peptidomiméticos Contendo Resíduos dos Aminoácidos Histidina , Tirosina e Aspartato . [s.l.] Universidade Federal de Santa Catarina, 2005.
SHIMAZAKI, M.; HASEGAWA, J.; KAN, K.; NOMURA, K.; NOSE, Y.; KONDO, H.; OHASHI, T.; WATANABE, K. Synthesis of captopril starting from an optically active BETA hydroxy acid. Chemical & Pharmaceutical Bulletin, v. 30, n. 9, p. 3139–3146, 1982.
































