Propargilação de aldeídos usando aleniltrifluoroborato de potássio promovida por BF3·Et2O
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Freitas, J.J.R. (UFRPE/UAST) ; Freitas, Q.P.S.B. (UFPE) ; Freitas, J.C.R. (UFCG/CES) ; Olibeira, R.A. (UFPE) ; Menezes, P.H. (UFPE)
Resumo
Neste trabalho é descrito a propargilação de aldeídos utilizando aleniltrifluoroborato de potássio, promovida por BF3Et2O. O método é simples e rápido, fornecendo os produtos com alto rendimento. Além disso, a reação é régio- e quimiosseletiva, levando exclusivamente a formação dos álcoois homopropargílicos.
Palavras chaves
Propargilação; Organotrifluoroboratos; Promotor
Introdução
Atualmente, um dos grandes desafios da química orgânica concerne no planejamento e desenvolvimento de estratégias sintéticas que sejam eficientes e seletivas e que visem a formação de novas ligações C-C (YUS et al., 2011). Diante deste cenário, uma estratégia sintética que vem se destacando é a reação de propargilação de compostos carbonílicos (DING e HOU, 2011). No entanto, este tipo de reação merece uma atenção especial, pois dependendo das condições reacionais utilizadas, a propargilação pode levar a uma mistura de produtos (WISNIEWSKA e JARVO, 2013). Neste sentido, este trabalho descreve um método seletivo, simples e limpo, baseado na adição de compostos de boro à aldeídos para levar aos álcoois homopropargílicos correspondentes, utilizando BF3•Et2O.
Material e métodos
Os solventes comerciais foram purificados de acordo com os métodos descritos na literatura (PERRIN e AMAREGO, 1996). As purificações por cromatografia em coluna, foram efetuadas utilizando-se sílica-gel (230-400 mesh). As cromatografias em camada delgada (CCD) foram efetuadas utilizando-se placas de sílica-gel contendo indicador fluorescente F254 da Merck. Para visualização, as placas foram colocadas em luz ultravioleta e solução de vanilina. Os espectros de RMN 1H e 13C foram registrados em um espectrômetro Varian Unity Plus de 300 MHz ou em um espectrômetro Varian URMNS de 400 MHz, empregando-se CDCl3 como solvente. A obtenção dos álcoois homopropargílicos se deu da seguinte maneira: em um balão de 25 mL, contendo o aleniltrifluoroborato de potássio (218 mg; 1,50 mmol) e o aldeído apropriado (1,0 mmol) em THF anidro (5,0 mL), sob atmosfera de argônio, foi adicionado BF3•Et2O (0,5 mL, 4 mmol, 4 equiv.). A mistura reacional foi mantida em agitação por 30 minutos. Em seguida, adicionou-se à mistura uma solução saturada de NaHCO3 (5,0 mL) e o precipitado formado foi filtrado. Na etapa seguinte, foi realizada a extração com diclorometano (3x20 mL), onde a fase orgânica foi seca com MgSO4, filtrada e o solvente removido sob pressão reduzida, levando aos produtos, sem necessidade de purificação.
Resultado e discussão
A otimização da metodologia foi iniciada com o estudo de dois parâmetros: o
uso de diferentes solventes e das quantidades de BF3·Et2O (1-4 equiv.).
Assim, o 4-NO2-benzaldeído e o aleniltrifluoroborato de potássio, foram
tratados com uma quantidade específica de BF3·Et2O, em diferentes solventes
(tabela 1). Quando foi utilizado CH2Cl2, o produto foi obtido com baixo
rendimento, devido à baixa solubilidade do aleniltrifluoroborato de potássio
neste solvente. Um melhor resultado foi obtido quando utilizou-se MeCN, mas
devido a preocupações ambientais e à toxicidade desse solvente, o mesmo foi
descartado. O melhor resultado foi obtido com o uso de THF como solvente
(tabela 1, entrada 3). O segundo parâmetro estudado foi a quantidade de
BF3·Et2O, onde o melhor resultado foi obtido quando utilizou-se 4
equivalentes do promotor, em THF, após 30 min de reação, sendo o produto
obtido com rendimento de 91%. A metodologia foi então estendida para
diferentes aldeídos (tabela 2). De acordo com a tabela 2, foi possível
observar que, para os aldeídos aromáticos contendo substituintes doadores e
retiradores de elétrons no anel, os produtos foram obtidos com rendimentos
semelhantes, indicando que a natureza eletrônica dos substituintes não tem
influência nesta reação (tabela 2, entradas 1 e 3). Quando foi utilizado o
cinamaldeído, um aldeído α,β-insaturado, o produto correspondente à adição
1,2- foi obtido exclusivamente, indicando que a reação é regiosseletiva. A
quimiosseletividade do método foi investigada frente a substratos contendo
diferentes funcionalidades e os álcoois homopropargílicos foram obtidos com
bons rendimentos (tabela 2, entradas 5-6), comprovando a eficácia do método.
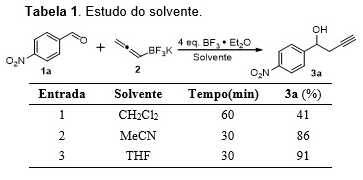
Efeito do solvente.
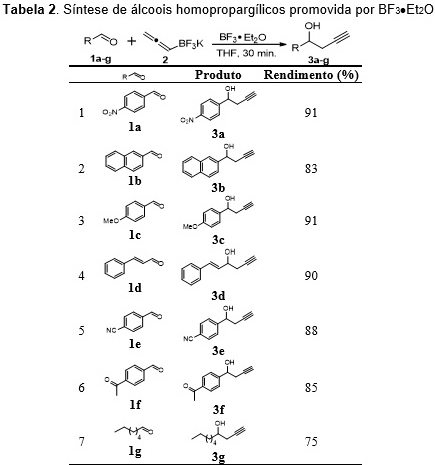
Síntese de álcoois homopropargílicos promovida por BF3Et2O.
Conclusões
Em suma, foram sintetizados diferentes álcoois homopropargílicos funcionalizados com rendimentos que variaram de bons a excelentes, em curto intervalo de tempo. A metodologia demonstrou ser simples, rápida e quimiosseletiva, uma vez que, a adição do grupo alenil aconteceu apenas na função carbonil de aldeídos. Adicionalmente, novos estudos estão em andamento, visando a ampliação dos resultados para outros aldeídos e a aplicação na síntese de produtos naturais.
Agradecimentos
UFPE, UFRPE, CNPq, FACEPE (APQ-0303-1.06/16)
Referências
Ding, C-H.; Hou, X-L. Catalytic Asymmetric Propargylation Chemical Reviews, 111, 1914-1937, 2011.
Perrin, D. D.; Amarego, W. L. F. Purification of Laboratory Chemicals, Pergamon Press: Oxford, 1996.
Wisniewska, H. M.; Jarvo, E. R. The Journal of Organic Chemistry, 78, 11629-11636, 2013.
Yus, M.; Gonzalez-Gomez, J. C.; Foubelo, F. Catalytic Enantioselective Allylation of Carbonyl Compounds and Imines. Chemical Reviews, 111, 7774-7854, 2011.
































