Avaliação do carvão ativado impregnado com hidróxido magnésio para refino do biogás.
ISBN 978-85-85905-21-7
Área
Bioquímica e Biotecnologia
Autores
Accioly, P.L. (UFPE) ; Lima Filho, N.M. (UFPE) ; Peres, S. (UPE) ; Palha, M.L.A.P.F. (UFPE)
Resumo
O biogás é resultante da digestão anaeróbica de substratos orgânicos biodegradáveis. Ao remover o CO2 do biogás, obtém-se o gás natural, metano, renovável. Dentre os métodos para remover o CO2 há a adsorção por modulação de pressão que pode utilizar o carvão ativado.A pesquisa teve como objetivo melhorar o carvão realçando as interações adsorbato-adsorvente entre sua superfície e o CO2, impregnando-o com Mg(OH)2. Determinou-se a capacidade de adsorção de CO2(0,76mol/kg) e avaliou-se a área superficial do carvão modificado(440,9 m2/g).O resultado da capacidade adsortiva de CO2 por área da superfície do carvão modificado foi de 19x10-7mol/m2. Esse resultado é superior aos valores encontrados na literatura e, portanto, acredita-se que a impregnação melhorou as interações adsorbato-adsorvente.
Palavras chaves
Biometano; Carvão ativado ; Hidróxido de magnésio
Introdução
O conteúdo do biogás é majoritariamente o CH4 e o CO2 onde segundo Ryckebosch, Drouillon e Vervaeren(2011), o biogás de biodigestores tem teores de CH4 entre 60 e 70%mol/mol e de CO2 entre 30 e 40%mol/mol. O alto percentual de CH4 eleva o poder calorífico do biogás e para que esse seja refinado a gás natural renovável é necessária a redução dos teores de CO2. Esta remoção é realizada por adsorção com modulação de pressão, que consiste em um leito fixo preenchido por um adsorvente capaz de capturar o CO2 sob pressão, e permitir a difusão do CH4. O adsorvente é o agente de separação e poderá capturar o adsorbato por meio das interações adsorbato-adsorvente, tais como atuam as zeólitas e o carvão ativado na adsorção de CO2 diante de misturas CO2/CH4. Porém, apesar das maiores capacidades de CO2 e maior seletividade desse pelas zeólitas, ao compará-las aos carvões, os carvões têm menores preços e não são hidrofílicos tais como as zeólitas em que a água compete pelos sítios de CO2(CHOI; DRESE; JONES, 2009). Há pesquisas que modificam o carvão e avaliam sua capacidade de adsorção de CO2 com o objetivo de melhorar o carvão para utilizá-lo na obtenção do gás natural renovável, tal como realizado por Lee et al.(2012). Os carvões ativados são formados por agrupamentos de grafenos em forma de camadas irregulares(MARSH; REINOSO, 2006) e o CO2 é um gás ácido. Portanto, sugere-se que a criação de sítios de adsorção de característica alcalina sobre a superfície do carvão melhora a interação entre CO2 e o carvão ativado. Por conseguinte, a pesquisa teve como objetivo averiguar essa proposta. Para tal, impregnou-se o carvão ativado com Mg(OH)2, verificou-se se o carvão modificado adsorve o CO2 diante de mistura sintética do biogás e avaliou-se as características de textura do carvão.
Material e métodos
Incialmente, preparou-se o carvão ativado comercial em pó, de marca Isofar. O tratamento consistiu na oxidação do carvão em HCl (0,1M), onde esse permaneceu imerso no ácido a 297K, a 1bar e por 30 minutos. Após essa etapa, filtrou-se o carvão, lavou-o com água destilada e o secou em estufa a 397K. A etapa de impregnação com Mg(OH)2 consistiu na imersão do carvão oxidado nessa solução alcalina a 1,0M por 4 horas. Após isso, o carvão foi filtrado, limpo com água destilada e seco em estufa a 397K. O carvão modificado foi nomeado de AC-Mg(OH)2 . A metodologia para impregnação alcalina do carvão foi baseada no preparo do adsorvente realizado por Tan et al.(2014). Após o tratamento do carvão, realizou-se o estudo adsortivo. Esse foi desenvolvido a partir da curva de ruptura resultante da avaliação composicional do gás efluente, por cromatografia, com o tempo operacional da coluna de adsorção. A coluna foi preenchida com 10g de carvão ativado modificado e o gás de alimentação estava a 1 bar, a 297K e a vazão de 3,3mL/s. No ensaio adsortivos o gás afluente simulava o biogás com teor de CO2 de 52,2% e de CH4 de 47,8%. A curva de ruptura foi ajustada à função sigmoidal e a partir do ajuste, determinou-se a quantidade retida de CO2, utilizando-se a equação:qt=1/m∙∫Q∙(Cs/Ce -1)dt, (Equação1) (BALSAMO et al.,2013). Sendo: qt, a capacidade de adsorção de CO2;Q, a vazão de CO2; t, o tempo de saturação; m, massa do carvão, Cs, teor de gás carbônico no gás de saída da coluna; Ce, teor de CO2 no gás de entrada. A caracterização do carvão impregnado foi realizada por meio da curva de adsorção de N2 a 77K, utilizando-se o modelo de BET para determinar a área superficial. A avaliação morfológica do carvão foi realizada por microscopia eletrônica de varredura.
Resultado e discussão
Nas curvas de rupturas (Figura 1), visualizou-se que as amostras iniciais
têm reduzidos teores de CO2 e altos, de CH4, evidenciando-se adsorção
preferencial do CO2 pelo AC-Mg(OH)2 em relação ao CH4, que se difunde pelo
leito. A Figura 1 também exibe o instante de ruptura (71s) e a saturação do
leito, isto é, o AC-Mg(OH)2 não adsorve o CO2. A partir da Equação 1,
determinou-se a quantidade de CO2 adsorvida pelo carvão sendo esta de 0,761
mol/kg.
A área superficial total do AC-Mg(OH)2 corresponde 440,92 m2/g comparando
esse resultado com de outros carvões da literatura (Tabela 1), observa-se
que o AC-Mg(OH)2 tem menor área. Esse valor está associado à impregnação com
solução (PLAZA et al.,2007). No entanto a relação da quantidade adsorvida
por área superficial do carvão do AC-Mg(OH)2 é de 19 x 10-7mol/m2, valor
superior aos demais carvões (Tabela 1). Este resultado propõe que o
tratamento alcalino reduz a área superficial do carvão, porém melhora as
interações adsorbato-adsorvente do AC-Mg(OH)2.
A análise morfológica (Figura 2) do AC-Mg(OH)2 exibiu depósitos no interior
dos macroporos. Os depósitos reduzem a superfície livre do carvão o que
explica a menor área superficial do AC-Mg(OH)2.
Porém, em razão do melhor resultado da capacidade adsortiva de CO2 por área,
19 x 10-7mol/m2, propõe-se que o Mg(OH)2 se deposita sobre o carvão,
afirmação corroborada por Liu et al.(2015) que, após tratarem o carvão com
NaOH, sugerem a ocupação do poros pelas moléculas alcalinas. Diante desse
pressuposto, a energia de Gibbs, a 297K e 1bar, da reação Mg(OH)2 + CO2 →
MgCO3 + H2O, é -2,74kJ. Portanto, a reação entre CO2 e Mg(OH)2 existe e essa
promove adsorção química que contribui para o melhor resultado de CO2
adsorvido por área do AC-Mg(OH)2.
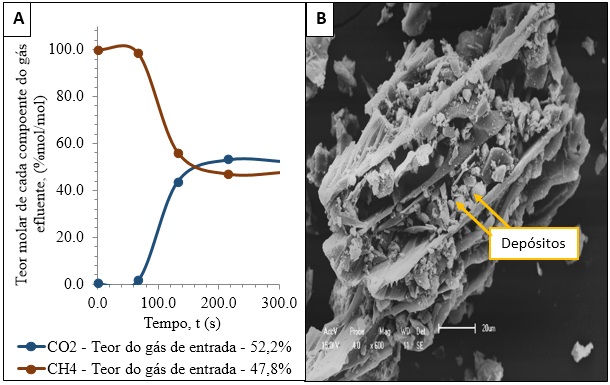
(A)Curvas de ruptura do gás carbônico e do gás metano,(B)Morfologia do carvão ativado impregnado por Mg(OH)2 obtida por MEV, onde 1cm equivale a 20µm.
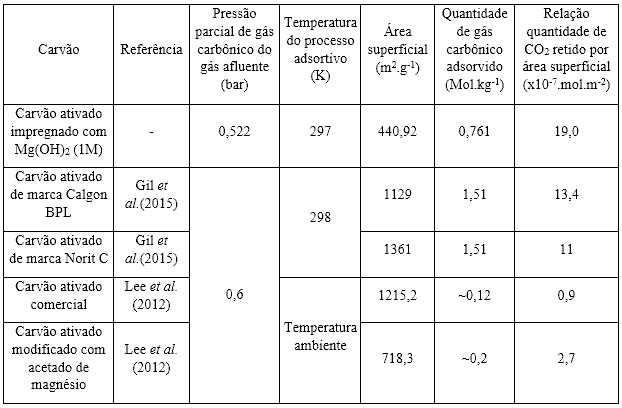
Comparativo entre o AC-Mg(OH)2 com alguns carvões da literatura em relação a capacidade de adsorção de gás carbônico e área superficial.
Conclusões
Diante dos resultados, observou-se que o AC-Mg(OH)2 adsorve o CO2 e permite a difusão de CH4 pelo leito. Portanto, pode-se obter um gás efluente rico em CH4. A relação entre a quantidade adsorvida de CO2 pela área superficial, o AC-Mg(OH)2 tem melhor resultado (19x10-7mol/m2). Isto mostra que a impregnação melhorou a interação adsorbato-adsorvente do carvão em razão da adsorção química do CO2.Essa pesquisa contribui para o melhoramento do carvão ativado, utilizando-se um tratamento simples, para fins de promover a o enriquecimento do conteúdo de CH4 do biogás, isto é, a obtenção do biometano.
Agradecimentos
Agradecimentos à equipe do Laboratório de Microbiologia do Departamento de Engenharia Química/UFPE, à todos da Policom/UPE e à CAPES pelo financiamento.
Referências
ANP. Resolução nº 8. Diário Oficial da União, 2015.
BALSAMO, M.; RODRÍGUEZ-REINOSO, F.; MONTAGNARO, F.; LANCIA, A.; ERTO, A. Highlighting the Role of Activated Carbon Particle Size on CO2 Capture from Model Flue Gas. Industrial & Engineering Chemistry Research,v.52, p.12183−12191, 2013.
CHOI, S.; DRESE, J. H.; JONES, C. W. Adsorbent materials for carbon dioxide capture from large anthropogenic point sources. ChemSusChem, v. 2, n. 9, p. 796-854, 2009.
GIL, M.V.; ALVAREZ-GUTIERREZ, N.; MARTINEZ, M.; RUBIERA, F.; PEVIDA, C.; MORAN, A. Carbon adsorbents for CO2 capture from bio-hydrogen and biogas streams: breakthrough adsorption study. Chemical Engineering Journal p. 148–158, 2015.
LEE, K. M.; LIM, Y. H.; PARK, C. J.; JO, Y. M. Adsorption of low-level CO2 using modified zeolites and activated carbon. Industrial & Engineering Chemistry Research, v.51, p.1355-1363, 2012.
LILLO-RÓDENAS, M. A.; JUAN-JUAN, J.; CAZORLA-AMORÓS, A.; LINARES-SOLANO,A. About reactions occuring during chemical activation with hydroxides.Carbon. v.42, p.1371-1375, 2004
LIU, Z.; PENG, Y.; HUANG, C.; HUNG, M. Application of thermogravimetry and differential scanning calorimetry for the evaluation of CO2 adsorption on chemically modified adsorbents. Thermochimica Acta, p. 8–14, 2015
MARSH, H.; REINOSO, F. R. Activated carbon. Elsevier, 2006
PLAZA, M. G.; PEVIDA, C.; ARENILLAS, A.; RUBIERA, F.; PIS, J. J. CO2 capture by adsorption with nitrogen enriched carbons. Fuel, v.86(14), p.2204-2212, 2007.
RYCKEBOSCH, E.; DROUILLON, M.; VERVAEREN, H. Techniques for transformation of biogas to biomethane. Biomass and bioenergy, v. 35, n. 5, p. 1633-1645, 2011.
TAN, Y. L.; ISLAM, M. A.; ASIF, M.; HAMEED, B. H. Adsorption of carbon dioxide by sodium hydroxide-modified granular coconut shell activated carbon in a fixed bed. Energy, v.77, p.926-931, 2014
































