Desenvolvimento de membrana de quitosana e gelatina contendo nanopartículas de prata
ISBN 978-85-85905-21-7
Área
Materiais
Autores
Moraes, D. (UNIVERSIDADE DE SÃO PAULO) ; Rigo, E. (UNIVERSIDADE DE SÃO PAULO) ; Luci, V. (UNIVERSIDADE DE SÃO PAULO)
Resumo
O uso de compostos naturais em produtos que visam o processo de cicatrização, tem sido utilizado ao longo dos séculos. O processo de cicatrização apesar de ser complexo, muitas vezes falha devido alguma enfermidade ou a ineficácia de fármacos. Utilizando biomateriais, será possível desenvolver um produto com o potencial cicatrizante, muitos estudos comprovaram a biocompatibilidade da quitosana e a ação antimicrobiana das nanopartículas de prata. Esse trabalho desenvolveu uma membrana com esses compostos, e por meio de ensaios de intumescimento, UV-VIS e IC50, constatou-se que a membrana apresenta alto grau de intumescimento, podendo assim transportar fármacos e compostos do sistema imune, afinidade com as nanopartículas de prata, grande estabilidade e biocompatibilidade.
Palavras chaves
nanoparticula de prata; quitosana; biomaterial
Introdução
A quitosana é muito utilizada na engenharia de tecidos devido as suas propriedades atóxicas, biodegradável e biocompatíveis. Esse polímero está envolvido nas interações de glicosaminoglicanos, um composto de suma importância para ativar os fatores de crescimento celular, atuando na composição da matriz e da superfície celular (ELSAKA; ELNAGHY, 2012; GONZALEZ, 2016; L. D. MENDES, J. D. BRESOLIN, O. B; G. ASSIS, 2016). As membranas são redes tridimensionais de polímeros que podem turgescer em meio aquoso retendo grande quantidade de água em sua estrutura sem dissolver, sendo aplicados em diversas áreas da medicina como em enxertos, curativos e na engenharia de tecidos (HORN; MARTINS; PLEPIS, 2010). A gelatina assim como a quitosana é biodegradável e biocompatível presença da gelatina na membrana irá somar nas propriedades cicatrizantes, devido a presença de componentes como lipídios e o ácido úsnico, os quais são podem auxiliar no carregamento de fármacos e pelas propriedades bacterianas (NUNES et al., 2016). As nanopartículas de prata (AgNPs) possuem uma ação biocida muito ampla e eficaz, sendo possível eliminar tanto bactérias aeróbicas quanto anaeróbicas(CHOI; HU, 2008), O mecanismo proposto de como as AgNP podem combater as bactérias, é através da liberação de íons Ag+ seguida pela produção espécies reativas de oxigênio (ROS) levando à danos estruturais, morfológicos e fisiológicos (HWANG et al., 2008). A incorporação de nanopartículas na membrana de quitosana proporciona o fortalecimento da matriz do mesmo, resultando em numa membrana mais estável.Sendo que as nanopartículas podem melhorar a elasticidade da rede de polímeros e aumentar a resistência mecânica, além de incorporar as características funcionais das nanopartículas utilizadas(LI et al., 2016).
Material e métodos
Para a produção das NPAg: A rota de síntese para a obtenção da AgNPs é descrita por WEI, D., QIAN, (2008) e adotada com modificações no Grupo de Nanotecnologia, Biomateriais e Biossensores- NanoBioDev. Para o preparo da solução contendo as AgNPs, foi utilizado uma solução de AgNO3 60 mM e solução de 6,92 mg/ml de quitosana em ácido acético 1% (v/v). Essa mistura foi homogeneizada no agitador magnético e depois colocada em tubos de ensaio, mantidos em banho- maria a 90ºC durante 21 horas. Para a produção das membranas: A membrana de quitosana foi obtida por meio de dissolução da quitosana (Sigma-Aldrich) em uma solução aquosa de ácido acético glacial 1 %, logo foi adicionado as NPAg a fim de obter uma concentração final de 2,20 mg/ml, seguida pela adição de gelatina (1:1), após a homogeneização foi adicionado glicerina 0,5%. Para formação da estrutura da membrana, foi alíquotado 25 ml da mistura em placas de Petri estéreis. Neutralização: as membranas foram mergulhadas em NaOH 1 M por 2 horas, seguida por lavagens seriadas até obter pH de 7. Análises: Foram feitas teste de citotoxidade de vermelho neutro (IC50) com células CHO, UV-VIS das NPAg e das membranas e ensaio de intumescimento com tampão a 38ºC.
Resultado e discussão
As NPAg são modificadas pela quitosana devido a presença do grupo amino e hidroxila no biopolímero, esses grupos facilitam a
adsorção entre a quitosana e íons metálico (REICHA et al., 2012; CHEN et al., 2013). Através de análise de UV-VIS foi
possível observar dois picos de onda: 425nm a 450 nm referente às NPAg e um pico em 310 nm referente a quitosana, as
nanopartículas metálicas podem apresentar grande absorção no espectro visível, no qual é possível observar uma área maior
no intervalo referente às NPAg (425nm a 450 nm), assim é possível afirmar que a distribuição, tamanho e formato da mesma
está uniforme devido que os espectros apresentaram uma banda centrada no mesmo intervalo, característica de NPAg esférica,
confirmando desta maneira a presença de NPAg na solução de quitosana e nitrato de prata. as membranas foram produzidas
contendo as NPAg (MNPAg)(NETO, 2010; VIMALA et al., 2010; MOHAMMADI; KHAYATIAN, 2017).O aspecto morfológico, observado a
olho nu, das MNPAg devido à alta concentração de NPAg resultou numa coloração dourada/amarela, sem odor, maleável e com
espessura média de 21,25 mm, essa espessura está relacionada a alta viscosidade da solução MNPAg. O ensaio de intumescimento
apresentou alta capacidade de hidratação, foi observado perda da massa apenas após 12 horas. A capacidade de intumescimento
é uma importante característica de materiais para aplicação em regeneração cutânea, devido que são capazes de absorver o
excessos de exsudato produzido pelo ferimento, e assim manter o local úmido (ALAN et al., 2016).O teste de IC50, apresentou
toxico para concentração inicial de 2,20mg/ml, mas com concentração de 0,50 mg/ml houve viabilidade celular. a toxidade é
devido a interferência na atividade mitocondrial nas células (CHEN, 2008; CHOI,2009).

Membrana de quitosana 2%/gelatina 4% com nanopartpiculas de prata com concentração final de 2,20 mg/ml.
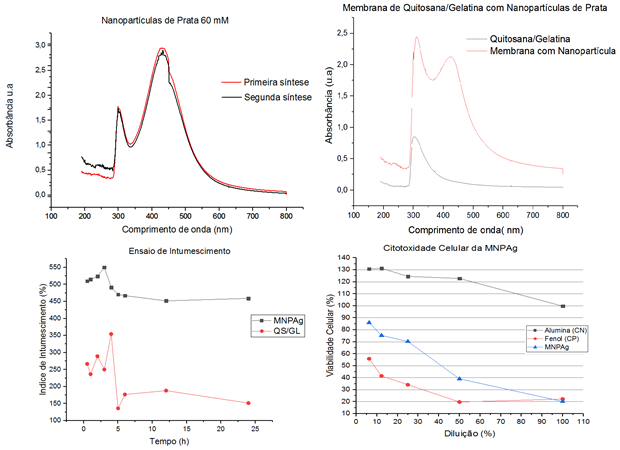
Nesta figura é possível observar os resultados obtidos através de UV-VIS, ensaio de intumescimento e de citotoxidade com células animais CHO.
Conclusões
Como a quitosana e a gelatina são biocompatíveis, o efeito citotóxico é devido a alta concentração de NPAg, alguns estudos sobre a citotoxidade das NPAg obtiveram resultados positivos com concentrações menores que 420 µg/ml, e também é encontrado baixa citotoxidade em concentrações molares em torno de 9 nM . Com esses resultados será possível delimitar uma concentração de NPAg que não causam efeitos citotóxicos. Garatindo dessa forma um curativo natural e biocompatível.
Agradecimentos
Referências
ALAN, A.; KEITH, C.; MARK; G, R.; KAREN, O. The Importance of Hydration in Wound Healing: Reinvigorating the clinical perspective. Journal of wound care, v. 25, n. 3, p. 122–130, 2016.
CHEN, X.; SCHLUESENER, H. J. Nanosilver : A nanoproduct in medical application. v. 176, p. 1–12, 2008.
CHEN, Z.; ZHANG, X.; CAO, H.; HUANG, Y. Chitosan-capped silver nanoparticles as a highly selective colorimetric probe for visual detection of aromatic ortho-trihydroxy phenols. The Royal Society of Chemistry, 2013.
CHOI, O.; HU, Z. Size dependent and reactive oxygen species related nanosilver toxicity to nitrifying bacteria. Environmental science & technology, v. 42, n. 12, p. 4583–4588, 2008. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/18605590>.
ELSAKA, S. E.; ELNAGHY, A. M. Antibacterial activity of calcium hydroxide combined with chitosan solutions and the outcomes on the bond strength of RealSeal sealer to radicular dentin. Journal of biomedical research, v. 26, n. 3, p. 193–9, 2012.
GONZALEZ, E. A. Efeitos da inibição da catepsina B sobre a doença cardiovascular na mucopolissacaridose tipo I. p. 76, 2016.
HORN, M. M.; MARTINS, V. C. A.; PLEPIS, A. M. D. G. Determinação da energia de ativação em hidrogéis poliméricos a partir de dados termogravimétricos. Polímeros, v. 20, p. 201–204, 2010.
HWANG, E. T. et al. Analysis of the toxic mode of action of silver nanoparticles using stress-specific bioluminescent bacteria. Small, v. 4, n. 6, p. 746–750, 2008.
L. D. MENDES, J. D. BRESOLIN, O. B; G. ASSIS, D. DE B. AVALIAÇÃO IN VITRO DA AÇÃO DA QUITOSANA E DE SEU DERIVADO QUATERNIZADO NA INIBIÇÃO DO CRESCIMENTO DO FUNGO PENICILLIUM EXPANSUM. v. 10, n. 1, p. 116–128, 2016.
LI, Q. et al. Controlling hydrogel mechanics via bio-inspired polymer-nanoparticle bond dynamics. ACS Nano, v. 10, n. 1, p. 1317–1324, 2016.
MIAO, A.; SCHWEHR, K. A.; XU, C.; ZHANG, S.; LUO, Z.; QUIGG, A.; SANTSCHI, P. H. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances. Environmental Pollution, v. 157, n. 11, p. 3034–3041, 2009. Disponível em: <http://dx.doi.org/10.1016/j.envpol.2009.05.047>.
MOHAMMADI, S.; KHAYATIAN, G. Spectrochimica Acta Part A : Molecular and Biomolecular Spectroscopy Colorimetric detection of biothiols based on aggregation of chitosan-stabilized silver nanoparticles. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, v. 185, p. 27–34, 2017. Disponível em: <http://dx.doi.org/10.1016/j.saa.2017.05.034>.
NETO, E. A. B. Desenvolvimento de nanobiocompósitos contendo nanopartículas de prata para aplicações bactericidas. Instituto de Física de São Carlos, 2010.
NUNES, P. S. et al. Gelatin-based membrane containing usnic acid-loaded liposome improves dermal burn healing in a porcine model. International Journal of Pharmaceutics, v. 513, n. 1–2, p. 473–482, 2016.
REICHA, F. M.; SARHAN, A.; ABDEL-HAMID, M. I.; EL-SHERBINY, I. M. Preparation of silver nanoparticles in the presence of chitosan by electrochemical method. Carbohydrate Polymers, v. 89, n. 1, p. 236–244, 2012.
VIMALA, K.; MOHAN, Y. M.; SIVUDU, K. S.; VARAPRASAD, K.; RAVINDRA, S.; REDDY, N. N.; PADMA, Y.; SREEDHAR, B.; MOHANARAJU, K. Fabrication of porous chitosan films impregnated with silver nanoparticles: A facile approach for superior antibacterial application. Colloids and Surfaces B: Biointerfaces, v. 76, n. 1, p. 248–258, 2010.
WEI, D., QIAN, W. Facile synthesis of Ag and Au nanoparticles utilizing chitosan as a mediator agent. Col. Surf. B, Biointerfaces, v. 62, n. 1, p. 136–142, 2008.
































