SÍNTESE E AVALIAÇÃO DA GENOTOXICIDADE DE UM BIOPOLÍMERO A PARTIR DA NORBIXINA EXTRAÍDA DO URUCUM (Bixa orellana L.)
ISBN 978-85-85905-21-7
Área
Materiais
Autores
Rodrigues, J.S. (UFPI) ; Junior, J.R.S. (UFPI) ; Viana, V.G.F. (IFPI) ; Costa, C.L.S. (FSA) ; Marques, R.B. (UESPI) ; Filho, A.L.M.M. (UESPI) ; Amaral, F.P.M. (UESPI) ; Ferreira, D.C.L. (UESPI) ; Figueiredo, F.C. (UFPI) ; Silva, D.K.B. (UESPI)
Resumo
Biopolímeros são polímeros produzidos a partir de substâncias naturais, de origem animal ou vegetal. Neste trabalho destaca-se a norbixina, obtida a partir da saponificação da bixina (extraída do urucum) em base forte. Na síntese do poliéster foi realizada a mistura de norbixina com glicerol em DMSO, sobre agitação até 140° C. As amostras foram analisadas pelas técnicas de Infravermelho, Ultravioleta e Visível. O polímero sintetizado apresentou picos FTIR característicos da formação de ligações éster nas regiões de 1750 a 1670 cm-1 e 1300 a 1000 cm-1. A ligação éster formada no polímero, foi confirmada com o aparecimento de uma banda com máximo em 277 nm nos espectros UV-Vis. A avaliação genotóxica através do teste de micronúcleo não evidenciou danos citotóxicos nos animais testados.
Palavras chaves
Bixa orellana; Biopolímero; Norbixina
Introdução
As moléculas derivadas de plantas apresentam ampla gama de propriedades estruturais e físico-químicas, o que as tornam fornecedoras importantes de matéria prima para o desenvolvimento de novos produtos. Um destes recursos é a bixina, um carotenoide atípico que possui uma cadeia isoprênica de 24 carbonos, contendo um ácido carboxílico e um éster metílico nas extremidades e nove ligações duplas conjugadas, perfazendo assim a fórmula molecular C25H30O4. A Bixina é obtida da mistura de pigmentos presentes no corante extraído do pericarpo das sementes de urucum (Bixa orellana L.) onde representa 80% dos pigmentos da espécie (COSTA; CHAVES, 2005). A busca por novos materiais polimericos com aplicação biologica podem induzir degradação e liberação de compostos de baixa massa molar, podendo ser muito carcinogênico e mutagênico. Portanto, os objetivos deste trabalho foram sintetizar e caracterizar um poliéster obtido a partir de norbixina e glicerol, bem como avaliar o seu possível efeito genotóxico.
Material e métodos
A norbixina usada neste trabalho, foi obtida a partir da saponificação da bixina (extraída do urucum) em KOH 5%. Na síntese do poliéster foi usado glicerol de grau analítico. Inicialmente a mistura de 1 para 2 de norbixina com glicerol em dimetilsulfóxido (DMSO), aquecida sobre agitação até 140° C. Nesta temperatura foi adicionado o catalisador acetato de cobalto e a solução resultante foi deixada em agitação por duas horas. Após esta etapa, a mistura foi filtrada, lavada e secada em estufa por 24 horas. Os biopolímeros foram analisados pelas técnicas de Infravermelho (FTIR), Ultravioleta e Visível (UV-Vis). Para avaliação da genotocicidade realizou-se o teste de micronúcleo onde o grupo exposto (E), composto por 05 ratos, recebeu a membrana introduzida no peritônio através de uma Laparotomia e estavam devidamente anestesiados. Foram submetidos à eutanásia 72 horas após o início do experimento. Foi coletado material da medula óssea de cada rato após a eutanásia para realização do teste do micronúcleo em eritrócito policromático, para avaliação do grau de genotoxicidade. Projeto aprovado pelo Comitê de Ética no Uso de Animais (CEUA), com número de protocolo 069/14. Os dados foram analisados utilizando One-Way ANOVA e teste Tukey. Para todos os testes foi considerado um nível de significância de 5%. Os resultados foram expressos como médias, ou seja, desvio padrão das três experiências independentes. O resultado foi considerado positivo quando houve um aumento estatisticamente significante (p <0,05).
Resultado e discussão
O biopolímero sintetizado apresentou picos FTIR característicos da formação
de ligações éster nas regiões de 1750 a 1670 cm-1 e 1300 a 1000 cm-1. A
ligação éster formada no polímero, foi confirmada com o aparecimento de uma
banda com máximo em 277 nm nos espectros UV-Vis. Sendo observado também a
permaneça das três bandas de ligações pi características da norbixina
(Figura 1).
A estabilidade térmica do poliéster obtido é semelhante ao da norbixina, com
inicio de degradação do polímero dando inicio aproximadamente em 250ºC. O
resultado DSC, indicou que o polímero e semi-cristalino, pois apresenta
temperatura de transição vítrea e temperatura de fusão. Avaliou-se o
potencial genotóxico da membrana de poliéster obtido da norbixina extraída
do urucum sobre as células da medula óssea de Rattus norvegicus.
Tabela 1: Valores médios de micronúcleos encontrados nos grupos expostos de
forma aguda e crônica ao poliéster obtido a partir da norbixina extraída do
Urucum (Bixa orellana L.)
A Tabela 1 mostra a média de micronúcleos para os grupos expostos de forma
aguda e crônica. As médias para a exposição aguda foram 10,0±1,581 (controle
negativo), 13,8±2,588 (tratado) e 34,4±2,7 (ciclofosfamida), representando
uma diferença estatística significante entre os grupos tratado e
ciclofosfamida com p<0,001. As médias para os grupos expostos cronicamente
foram 17,8±3,899 (controle negativo), 17,8±3
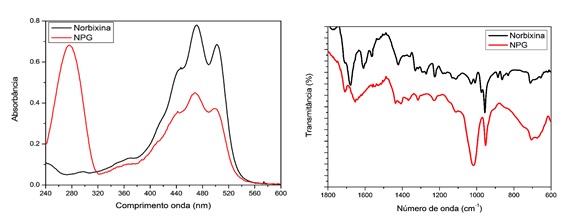
Espectros de infravermelho e UV-Vis da norbixina e biopolímero(NPG).

Valores médios de micronúcleos encontrados nos grupos expostos de forma aguda e crônica biopolímero obtido a partir da norbixina extraída do Urucum
Conclusões
A síntese do biopoliéster foi confirmada a partir do resultados de FTIR, UV- Vis e DSC. Sendo que os picos de ligação éster do polímero foi detectado no infravermelho. Fato este confirmado com a presença de uma banda com máximo em 277 nm no UV-Vis. Outro indicativo da formação do poliéster foi a presença de um evento de transição vítrea no gráfico DSC do polímero. O biopolímero não mostrou efeito genotóxico através do teste de micronúcleo.
Agradecimentos
RENORBIO (UFPI), UESPI, IFPI, FACID, FSA
Referências
COSTA, C. L. S.; CHAVES, M.H. Extração de pigmentos das sementes de Bixa orellana L.: uma alternativa para disciplinas experimentais de química orgânica. Quim. Nova. 28 (1); 2005. 149-152.
































