AVALIAÇÃO DA EFICIÊNCIA CATALÍTICA DE LIPASES COMBINADAS NA SÍNTESE DE OLEATO DE ETILA
ISBN 978-85-85905-21-7
Área
Iniciação Científica
Autores
Gomes, P.H.L. (UNILAB) ; Cavalcante, F.T.T. (UNILAB) ; Souza, M.C.M. (UNILAB) ; Santos, J.C.S. (UNILAB) ; Fonseca, A.M. (UNILAB) ; Jesus, F. (UNILAB)
Resumo
A utilização de lipases em processos enzimáticos é favorável devido à sua excelente especificidade ao substrato, estereosseletividade e por possuir baixo impacto ambiental comparado aos processos convencionais. O estudo da síntese enzimática de oleato de etila é importante pela sua ampla utilização na indústria cosmética e alimentícia, e ainda, por ser um dos principais componentes do biodiesel. A síntese de oleato de etila ocorreu por esterificação via combinação de lipases, enzimas comerciais. As reações ocorreram em frascos de 2ml, com temperatura e agitação controlada, em um banho termostático. Dentre as reações realizadas, a que usou a combinação de 75% de RM-IM e 25% de Novozym®435 alcançou uma conversão de 86,54%, enquanto a combinação de 75% de TL-IM e 25% de RM-IM obteve 70,11%.
Palavras chaves
Combinação de enzimas; Oleato de etila; Esterificação
Introdução
O oleato de etila é um exemplo de éster de ácido graxo e pode ser utilizado como biodiesel, aditivo para diesel e na indústria cosmética e alimentícia (SOUZA,2013). As lipases são as enzimas mais utilizadas em biocatálise devido à sua ampla especificidade, elevada estabilidade sob diferentes condições e meios de reação, além de catalisar uma grande variedade de reações, dentre elas a produção de biodiesel (SANTOS, 2015). A combinação de lipases é uma proposta de otimização de reações baseada no princípio de ataque das enzimas em diferentes posições dos triglicerídeos contidos no substrato utilizado (ALVES, et al., 2014). Este trabalho possui como objetivo encontrar a melhor combinação das lipases comerciais Novozym® 435, Lipozym® TL-IM, Lipozym® RM-IM para a síntese do oleato de etila nas melhores condições obtidas em um estudo anterior realizado por Souza (2013).
Material e métodos
As enzimas comerciais Novozym®435, Lipozym®TL-IM, Lipozym®RM-IM foram doadas pela Novozymes A/S (Espanha). O ácido oleico foi obtido da Synth (São Paulo, Brasil) e o etanol da Dinâmica Química Contemporânea LTDA (São Paulo, Brasil). Os demais reagentes foram de grau analítico. Para fins de cálculos, criação de tabelas e gráficos foram utilizados o Excel 2010 da Microsoft® e o OriginPro 9.1 do OriginLab®. As enzimas foram combinadas em pares para que a enzima A mantivesse seu percentual variando de 0 a 100% ao passo que a enzima B completasse o percentual restante para totalizar 100% do valor da massa do catalisador utilizado na reação, como é apresentado na tabela 1. Assim, foram geradas as combinações entre os diferentes biocatalisadores conforme apresenta a tabela 2. A síntese de oleato de etila foi realizada por meio da esterificação do ácido oleico e etanol, para uma razão molar 1:1, na presença das diferentes combinações de enzimas apresentadas. O quantitativo dos reagentes mencionados aqui teve como base a reação do oleato de etila realizada por Souza (2013). As reações ocorreram em frascos de 2ml a 37°C e 150 RPM gerados por um banho termostático para um período de até 24 horas. Por meio do gotejamento de uma solução de NaOH 0,2 molar titulou-se a massa da amostra a ser analisada(MA), etanol neutralizado e 3 gotas de fenolftaleína contidos em um erlenmeyer até o aparecimento da cor rosa clara permanente. Para determinação do índice de acidez (1) e do valor da conversão em ésteres (2) usaram-se as equações a seguir (SANTOS, 2011). Com base no valor de MA e do volume de NaOH gasto na titulação foi determinado o índice de acidez (IA). Já a conversão em ésteres foi obtida pela divisão do resultado da subtração entre o IA do branco e o IA da amostra pelo IA do branco.
Resultado e discussão
Das reações realizadas a melhor conversão surgiu da combinação de 75% (Lipozym®
RM-IM) e 25% (Novozym®435) alcançando 86,54%, enquanto a pior conversão foi
obtida da combinação de 75% (Lipozym® TL-IM) e 25% (Lipozym® RM-IM) na ordem de
70,11%. Por ser um sistema heterogêneo e livre de solvente a taxa de
transferência de massa é limitada devido às baixas taxas de difusão do reagente
para o sítio ativo da enzima (RICHETTI, 2009).
Analisando a figura 1, percebe-se que há um aumento da conversão à medida que a
porcentagem da Lipozym® TL-IM nas combinações junto a Lipozym® RM-IM é reduzida.
Entretanto, para as combinações junto a Novozym® 435, não foi observado aumento
nem redução na conversão obtida. Comparando o valor de conversão individual de
67,87% com os das combinações, podemos dizer que a Lipozym® TL-IM combinada com
as outras enzimas teve sua conversão melhorada.
Ao avaliar a combinação entre Lipozym® RM-IM e Novozym® 435, percebeu-se que há
um pequeno aumento da conversão à medida que a porcentagem da Lipozym® RM-IM na
combinação é superior a porcentagem de Novozym® 435. Aguieiras, Souza, e Langone
(2013) usando a Lipozym® RM-IM obtiveram conversões superiores a 90% na síntese
de oleato de etila em um reator batelada fechado a 40°C após 2h de reação.
Utilizando a Novozym® 435, Souza (2013), atingiu uma conversão de
aproximadamente 90% em 24h a 37°C sob agitação orbital. O uso individual da
Novozym® 435 e da Lipozym® RM-IM teve melhor conversão comparada com suas
combinações. Isso se dá devido a capacidade da Novozym® 435, como lipase não-
específica, de poder catalisar o substrato independente da região do grupo
funcional, ao contrário das lipases 1,3 específicas (Lipozym® TL-IM e RM-IM) que
são regiosseletivas (VÉRAS, 2012).
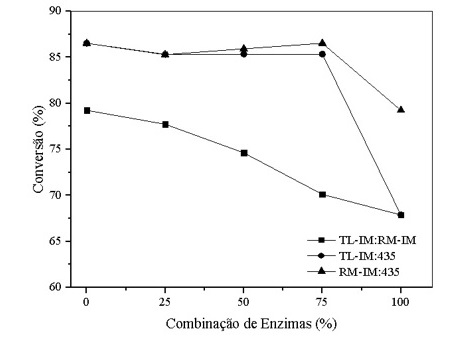
Lipozym®TL-IM e Lipozym®RM-IM(■), Lipozym®TL-IM e Novozym®435(●) e Lipozym®RM-IM e Novozym®435(▲), razão molar 1:1, 37°C e 150 RPM durante 24 horas.
Conclusões
Ao analisar os resultados das reações da síntese de oleato de etila, observou-se que a combinação de enzimas foi positivamente favorável ao aumento da conversão para as situações em que existe o aumento da presença da Lipozym® RM-IM ou Novozym® 435 junto a Lipozym® TL-IM, e Lipozym® RM-IM junto a Novozym® 435, por exemplo, o uso de 25% de Novozym® 435 junto a 75% de Lipozym® TL-IM elevou a conversão de 67,87% para 85,35%. Entretanto, o sentido inverso desfavorece a conversão. Contudo, foi verificado que enzimas combinadas podem aumentar o rendimento da síntese de oleato de etila.
Agradecimentos
Os autores agradecem a todos que contribuíram direta e indiretamente em especial ao apoio financeiro fornecido pela UNILAB.
Referências
AGUIEIRAS, E. C. G.; SOUZA, S. L.; LANGONE, M. A. P. Estudo do comportamento da lipase comercial Lipozyme RM IM em reações de esterificação para obtenção de biodiesel. Quím. Nova. 2013, vol.36, n.5, pp.646-650. ISSN 0100-4042.
ALVES, J. S. et al. 2014. Combi-lipase for heterogeneous substrates: a new approach for hydrolysis of soybean oil using mixtures of biocatalysts. RSC Adv., 2014, 4, 6863.
PINHEIRO, Maísa Pessoa. Et al. 2015. Produção enzimática de oleato de etila catalisada pela lipase de Candida sp.imobilizada em suporte macroporoso (immobead-350). 10º Congresso internacional de bioenergia, 2015.
SOUZA, Maria Cristiane Martins de. Imobilização de lipase de Candida Antarctica do tipo B em nanopartículas magnéticas visando a aplicação na síntese de ésteres. 2013. 88 f. Tese (Doutorado) - Curso de Engenharia Química, Universidade Federal do Ceará, Fortaleza, 2013.
RICHETTI, Aline. Esterificação enzimática de palmitato de 2-etilexila em sistema livre de solvente. 2009. 101 f. Dissertação (Mestrado) - Curso de Tecnologia de Processos Químicos e Bioquímicos, Universidade Federal do Rio de Janeiro, Rio de Janeiro, 2009.
SANTOS, José Cleiton Sousa dos. Otimização de biocatalizadores: desenvolvimento de estratégias para modulação de propriedades de enzimas por técnicas físicas e químicas. 2015. 333 f. Dissertação (Mestrado) - Curso de Engenharia Química, Engenharia Química, Universidade Federal do Ceará, Fortaleza, 2015.
SANTOS, José Cleiton Sousa dos. Estudo de parâmetros nas reações de síntese enzimática de biodiesel por intermédio de fluidos supercríticos. 2011. 102 f. Dissertação (Mestrado) - Curso de Engenharia Química, Universidade Federal do Ceará, Fortaleza, 2011.
VÉRAS, Ilvania Costa. EXPRESSÃO HETERÓLOGA DE LIPASES MODIFICADAS PARA MELHORAMENTO DO PROCESSO DE PRODUÇÃO ENZIMÁTICA DE BIODIESEL. 2012. 140 f. Dissertação (Mestrado) - Curso de Biotecnologia, Universidade Federal da Bahia, Salvador, 2012.
































