DECOMPOSIÇÃO DO PERÓXIDO DE HIDROGÊNIO SOBRE CATALISADOR DE MANGANÊS
ISBN 978-85-85905-21-7
Área
Iniciação Científica
Autores
Costa Reis, A. (UFPA) ; Santos, L.S. (UFPA) ; Fernando da Paixão Ribeiro, N. (UFPA)
Resumo
O entendimento da decomposição do H2O2 relacionado ao meio reacional é de extrema importância para aumentar a eficiência de geração dos radicais hidroxila por meio dos Processos Oxidativos Avançados (POA). O objetivo do trabalho é entender a influência de fatores de processo, tais como: temperatura, massa e velocidade de agitação na decomposição do peróxido de hidrogênio utilizando óxido de manganês como catalisador. Além disso, busca- se desenvolver um pratica laboratorial voltada aos alunos da graduação de forma para exemplificar o papel de tais paramentos na atividade e seletividade catalítica. A reação foi realizada em um reator de tanque agitado avaliando diferentes cinéticas para determinação da constante de velocidade e ordem reacional.
Palavras chaves
Oxidação; Cinética; Cinética Heterogênea
Introdução
O peróxido de hidrogênio (H2O2) é um dos mais versáteis oxidantes existentes, com poder de oxidação superior ao cloro, dióxido de cloro e permanganato de potássio (SCHUMB et al,1955). Esta característica confere ao H2O2 diversas aplicações, tais como em tratamentos de efluentes, remediação de solos contaminados, atuação na indústria alimentícia, farmacêutica e em monitoramento de processos, podendo também estar presente em inúmeras reações biológicas conforme exposto por MATTOS et al (2003). A síntese de H2O2 é principalmente realizada pela rota da metil- antraquinona, neste método ocorre a hidrogenação por substituição da antraquinona na presença de catalisadores como níquel ou paládio, formando o diol. Posteriormente o antraquinol é oxidado na presença de ar para a reforma da antraquinona original, produzindo assim o peróxido de hidrogênio (EDWARDS,2006). Este processo apresenta algumas limitações, principalmente relacionadas ao elevado custo de aplicação, dessa forma a busca por rotas alternativas de síntese de H2O2 tem sido amplamente investigada (GAIKWAD et al,2002). A decomposição do H2O2 ocorre geralmente a baixas temperaturas, sendo que na presença de catalisadores pode ocorrer até mesmo em temperaturas próximas a 0°C. Outros fatores como a presença de ácidos, ânions e suas concentrações no meio reacional, assim como a concentração inicial de H2O2 também podem afetar a reação, podendo inibi-la ou favorece-la. Além dos fatores anteriormente mencionados, as características do catalisador empregado têm o poder de influenciar na velocidade de decomposição do H2O2 (CHOUDHARY et al,2006). O objetivo neste trabalho é entender a influência de fatores processos na decomposição H2O2 e desenvolver uma prática laboratorial a ser implementada para estudantes de graduação.
Material e métodos
Foi estuda a reação de decomposição do peróxido de hidrogênio a temperatura ambiente. O meio reacional foi preparado a partir da adição de um volume definido de água destilada e massa de catalisador (0,05 e 0,2 g) em reator de vidro. O catalisador (MnO2) é mantido em suspensão por agitação magnética, de acordo com a velocidade estudada. O meio reacional é conectado ao equipamento de medição de O2, que em seguida é adicionado certo volume de H2O2 (0,5 a 5 mL), que é definido a partir da concentração pretendida. O sistema é conectado a um banho termostático para ajuste da temperatura de reação. O equipamento de medição do volume de oxigênio gerado consiste em duas buretas de 50 mL conectadas a um manômetro de tubo aberto, ambos conectados ao reator de vidro. Durante a reação ocorrerá a liberação de oxigênio devido a decomposição do H2O2 assim exercendo pressão no sistema medido pelo deslocamento de nível do manômetro de tubo aberto. O volume de oxigênio liberado durante a reação é proporcional a quantidade de água liberada nas buretas para equilibrar a pressão do sistema.
Resultado e discussão
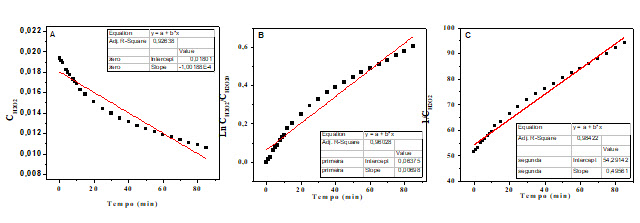
A reação de decomposição do peróxido de hidrogênio é dada por:
2H2O2→ H2O÷O2, a mesma ocorre em
baixas temperaturas na presença de catalisadores. Os catalisadores mais
utilizados para esta reação são: Pd, Fe, Co, Ni, Mn, Cr e Cu. Os metais de
transição, assim como os metais preciosos, podem ser suportados e
combinados, ou seja, a utilização de dois metais de transição diferentes em
um mesmo suporte de forma a maximizar a conversão fracional. A ordem de
reação foi avaliada utilizado o método integral, neste sentido, considerou-
se um sistema homogêneo e foi avaliado as ordens de reação zero, primeira e
segunda ordem. Com as equações obtidas na forma linear descritas nas
equações dadas a seguir: ordem zero CH2O2=CH2O20-kt;
primeira ordem Ln CH2O2/ CH2O20=-kt e segunda ordem
1/CH2O2-1/ CH2O20 =kt. A decomposição do
H2O2 foi realizada em pressão atmosférica em um
reator agitado magneticamente contendo 0,5 g de catalisador, no meio líquido
de reação (150 mL) a 29°C, e concentração inicial de
H2O2 0,01936 mol/L no reator, com os resultados
apresentados na Figura 1.A influência da concentração inicial de peroxido
sobre a constante de velocidade foi avaliada. Para o cálculo considerou-se
uma reação de segunda ordem em relação a concentração de peróxido. Os
resultados obtidos estão mostrados na Figura 2. Pode-se observar uma
dependência linear da constante de velocidade com a concentração inicial de
peroxido, resultados que estão de acordo com os dados encontrados na
literatura.
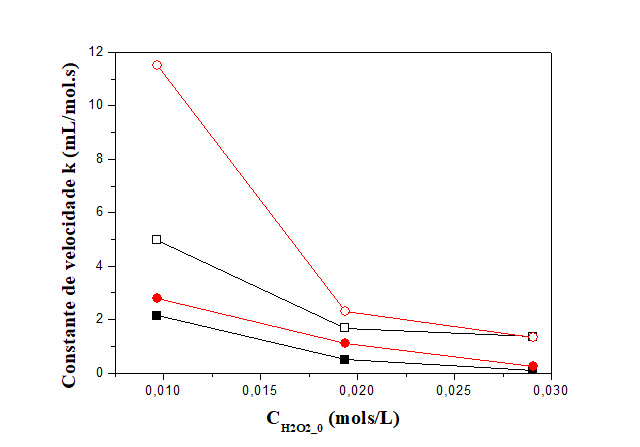
Influência da concentração inicial de peróxido sobre a constante cinética.
Conclusões
A partir da análise dos dados obtidos a utilização de óxido de manganês como catalisador para a decomposição do H2O2 é descrita por uma reação de segunda ordem eque aumento da concentração inicial provoca a diminuição da constante de velocidade. Além disto, foi desenvolvido a pratica experimental de forma eficiente que mostra a influência de parâmetros de processo sobre as variáveis cinéticas.
Agradecimentos
Referências
CARVALHO, A. Bianchi de; RODRIGUES, H. Vieira, AZEREDO, M. Santos. Caracterização de catalisadores de Co-Mo/Al2O3 para a produção de SWNT’s a partir da deposição química a vapor do CH4. 2015.Trabalho de Conclusão de Curso (Graduação em Engenharia Química) – Departamento de Química e de Petróleo. Universidade Federal Fluminense. Niterói.
CHOUDHARY, V. R.; SAMANTA, C.; CHOUDHARY T.V. Factors influencing decomposition of H2O2 over supported catalyst in aqueous medium. Journal of molecular catalysis. v. 260, n. 1-2, p.115-120, December. 2006.
EDWARDS, Jennifer Kelly. Direct synthesis of hydrogen peroxide from hydrogen and oxygen over catalysts containing gold. Cardiff University, 2006.
FOGLER,H.S.., Elementos de engenharia das Reações Químicas.4. ed. Rio de Janeiro, LTC,2013.
































