Efeitos do cloridrato de guanidina na auto-oxidação da hemoglobina de Glossoscolex paulistus (HbGp)
ISBN 978-85-85905-21-7
Área
Iniciação Científica
Autores
Silva, R.P. (UNIFESSPA) ; Simões, Y.S. (UNIFESSPA) ; Oliveira, T.M.B.F. (UNIFESSPA) ; Carvalho, F.A.O. (UNIFESSPA)
Resumo
Neste presente estudo, o mecanismo de auto-oxidação da HbGp foi avaliado em função da concentração do desnaturante cloridrato de guanidina (GuHCl), por espectroscopia no UV-VIS. Os dados mostram que o processo de auto-oxidação da HbGp na presença de GuHCl na faixa de 1,0 a 2,0 mol/L ocorre em duas etapas: um processo rápido com constante de velocidade (k1) entre 20 e 239 s-1 e um lento com k2 na faixa de 1,5 a 9,0 s-1, associados a auto-oxidação do ferro do monômero d e trímero abc, respectivamente. O aumento da concentração de GuHCl favorece ambos os processos, devido altas concentrações de GuHCl promover a desnaturação e expor o grupo heme ao solvente. Assim, os resultados indicam que a estrutura enovelada é indispensável para a manutenção da atividade biológica desta proteína.
Palavras chaves
HbGp; Cinética; Auto-oxidação
Introdução
A hemoglobina extracelular gigante de Glossoscolex paulistus (HbGp) é extraída de uma minhoca endêmica do estado de São Paulo. A espécie pertence ao filo Anelídea, à classe Oligochaeta e à família Glossoscolecidae (SANTIAGO et al, 2008). A HbGp tem massa molecular de 3,6 MDa e estrutura quaternária constituída por 144 cadeias com grupo heme (globinas), 36 cadeias sem o grupo heme (linkers), dispostas em duas camadas hexagonais. Cada camada é constituída por seis unidades (protômeros) de massa molecular 1/12 da molécula íntegra (CARVALHO et al, p. 183-193, 2011). Nos últimos anos, o interesse em estudar esta classe de proteína deve-se às suas propriedades singulares como, alta estabilidade oligomérica, resistência à auto-oxidação e alta cooperatividade quando comparada a hemoglobinas de mamíferos. Assim como ao potencial apresentado por estes sistemas em aplicações biomédicas como substituto sanguíneo (ROUSSELOT et al, p. 333-345, 2006). Recentemente, estudos tem mostrado que a HbGp possui atividade peroxidase sendo, portanto, capaz de catalisar várias moléculas, tais como o peróxido de hidrogênio. Grandes avanços na caracterização da HbGp, e sobre o efeito de agentes desnaturantes, variação de temperatura e pH, adição de agentes químicos surfactantes, guanidina e ureia nos processos de dissociação, desnaturação e agregação da HbGp foram obtidos. No entanto, pouco é conhecido sobre mudanças estruturais e as interações a nível molecular destes agentes com a estrutura desta proteína. Tendo isto em vista, a presente pesquisa tem como objetivo avaliar a cinética do processo de desnaturação desta proteína em função da concentração de guanidina, a fim de fornecer informações importantes sobre o mecanismo de desenovelamento desta macromolécula.
Material e métodos
A HbGp foi extraída e purificada, como reportado na literatura (SANTIAGO et al, 2010). Posteriormente, foi preparado um estoque 3,0 mg/mL em tampão tris-HCl 0,1 mol/L, pH 7,0 a partir de um estoque concentrado de proteína 24 mg/mL. Num mesmo tampão foi preparado uma solução estoque 5,0 mol/L de cloridrato de guanidina (GuHCl). Amostras de proteína 0,2 mg/mL expostas em diferentes concentrações de desnaturantes na faixa de 1,0 a 2,0 mol/L foram preparadas. No intuito de monitorar o início da reação foram adicionadas alíquotas de tampão e GuHCl seguidas de homogeneização e posteriormente segundos antes da reação foi adicionado o volume correspondente de proteína. Os experimentos foram realizados num espectrofotômetro UV-VIS da Biospectro, monitorando a variação da absorbância da amostra no comprimento de onda 414 nm em função do tempo. Realizou-se todos estes experimentos em triplicatas. As constantes de velocidades para cada concentração de desnaturante foram obtidas a partir de ajustes dos dados experimentais no programa origin, utilizando a combinação de cinéticas de primeira ordem com diferentes constantes de velocidades, que caracterizam os vários processos resultantes da interação da proteína com os desnaturantes. A equação usada nas análises dos dados é mostrada a seguir: A = ∆A1exp(-k1*t) + ∆A2exp(-k2*t) + A0 (Equação 1) Onde K1 e K2 são as constantes de velocidade de primeira ordem para os processos de oxidação rápido e lento, respectivamente. ∆A1 e ∆A2 são as variações de absorbância e A0 é a absorbância no infinito. Os ajustes através da equação 1 apresentam valores de R2 ≥ 0,994, e indicam que a oxidação da HbGp na presença de GuHCl é caracterizado por um processo bi exponencial.
Resultado e discussão
O estado de oxidação da HbGp, bem como os parâmetros estruturais da forma
nativa foram avaliados a partir das análises do espectro de absorção óptica
no UV-VIS e da distribuição de partículas espalhadas em função do tempo. O
espectro da HbGp purificada apresenta três bandas: a primeira banda intensa
centrada em 415 nm denominada banda de Soret e duas outras menos intensas,
as bandas Q (alfa e beta) centradas, respectivamente, em 540 nm e 575 nm,
que são características da proteína nativa (Dados não mostrados).
A Figura 1 mostra a variação da absorbância (abs) da HbGp em função do tempo
em diferentes concentrações da GuHCl. Na ausência de desnaturante os valores
de abs permanece constante sugerindo que nenhuma alteração ocorre no
ambiente do heme. Segundo STRAND e colaboradores, neste pH a proteína se
encontra na forma íntrega, onde o estado oligomérico é altamente preservado.
Entretanto, o aumento da concentração do desnaturante induz um decréscimo
nos valores de absorbância em função do tempo. Este comportamento indica que
o GuHCl favorece a auto-oxidação da proteína.
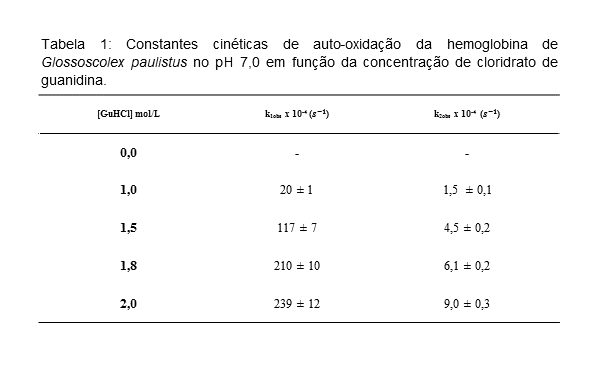
As constantes de velocidades em diferentes concentrações de GuHCl foram
obtidas através dos ajustes dos dados experimentais (Figura 1), e são
reportados na Tabela 1.
Na presença de 1,0 mol/L de GuHCl as constantes de velocidades do processo
rápido e lento, k1 e k2, são (20 ± 1) x 10-4 s-1 e (1,5 ± 0,1) x 10-4 s-1,
respectivamente. O aumento da concentração de GuHCl favorece ambos os
processos que são caracterizados por k1 e k2 com valores de (239 ± 12) x 10-
4 s-1 e (9,0 ± 0,3) x 10-4 s-1. As constantes k1 e k2 são atribuídas aos
processos de oxidação das subunidades, monômeros d e trímeros abc, que são
predominantes em altas concentrações de desnaturantes.
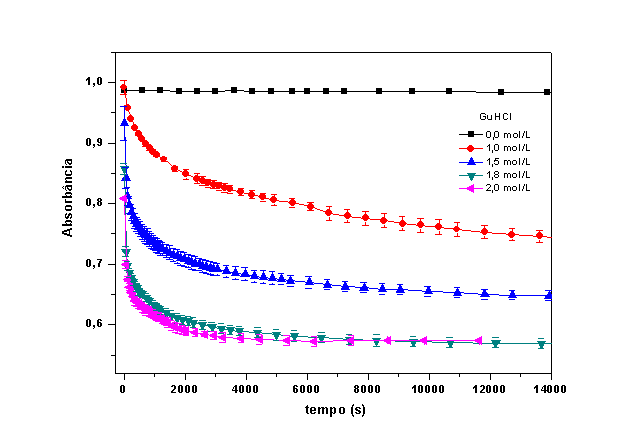
Curvas cinéticas da auto-oxidação da oxi-HbGp em tampão tris-HCl 0,1 mol/L, pH 7,0, nas concentrações de GuHCl indicadas.
Conclusões
O presente estudo mostra que o processo de auto-oxidação da HbGp na presença de GuHCl nas concentrações investigadas ocorre em duas etapas: um processo rápido e um lento associados a auto-oxidação do ferro das subunidades monoméricas e triméricas. Outrossim, o aumento da concentração do desnaturante favorece ambos os processos.
Agradecimentos
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo incentivo à pesquisa. Ao laboratório de Sedimentologia do IGE-UNIFESSPA.
Referências
1. CARVALHO, F.A.O.; SANTIAGO, P.S.; BORGES, J.C.; TABAK, M. Intern. J. Biol. Macrom., 48:183-193, 2011.
2. ROUSSELOT, M.; DEL´PY, E.; LA ROCHELLE, C.D.; LAGENTE, V.; PIROW, R.; REES, J.; HAGEGE, A.; LE GUEN, D.; HOURDEZ, S.; ZAL, F. Biotechnology J., 1:333-345, 2006.
3. SANTIAGO, P.S.; MOURA, F.; MOREIRA, L.M.; DOMINGUES, M.M.; SANTOS, N.C.; TABAK, M. Biophys. J., 94:2228-2240, 2008.
4. SANTIAGO, P.S.; CARVALHO, F.A.O.; DOMINGUES, M.M.; CARVALHO, J.W.P.; SANTOS, N.C.; TABAK, M. Isoelectric Point Determination for Glossoscolex paulistus Extracellular Hemoglobin: Oligomeric Stability in Acidic pH and Relevance to Protein-Surfactant Interactions. Langmuir, 2010.
5. STRAND, K.; KNAPP, J.E.; BHYRAVBHATIA, B.; ROYER JR., W.E. Crystal Structure of the Hemoglobin Dodecamer from Lumbricus Erythrocruorin: Allosteric Core of Giant Annelid Respiratory Complexes, J. Mol. Biol. 344:119-134, 2004.
































