Preparação do olivetol visando a síntese do canabidiol (CBD)
ISBN 978-85-85905-21-7
Área
Iniciação Científica
Autores
Domingos da Silva, N. (INSTITUTO FEDERAL DO RIO DE JANEIRO (IFRJ)) ; de Almeida Violante, F. (INSTITUTO FEDERAL DO RIO DE JANEIRO (IFRJ))
Resumo
O presente trabalho apresenta uma releitura da eficiente síntese descrita para o olivetol a partir de compostos carbonílicos. O olivetol foi utilizado como precursor na síntese do canabidiol (CBD), um importante canabinóide presente na planta Cannabis sativa L., que tem sido estudada clinicamente devido à inúmeras evidências de seu potencial contra crises convulsivas. Entretanto, pela dificuldade da obtenção ou cultivo legal desta planta há o crescente interesse na síntese do olivetol. Desta forma, um estudo mais detalhado da preparação do olivetol pode significar uma alternativa promissora para a sintese do canabidiol (CBD) e, portanto, um alento para o tratamento de pessoas acometidas pela epilepsia e outras doenças.
Palavras chaves
canabidiol; olivetol; compostos carbonílicos
Introdução
Com a descoberta da extensa atividade biológica das substâncias da maconha (Cannabis sativa L.), principalmente os canabinóides, foi desenvolvido um grande interesse por esses compostos (ANAND, 1983). Através dos esforços sintéticos para a síntese de diversos canabinóides, sobretudo para o canabidiol (CBD) e para o THC, muito se avançou nesta área. As sínteses descritas para o CBD, em geral usam o olivetol como precursor. Para a preparação do olivetol, algumas rotas utilizaram como materiais de partida o ácido 2,5-dimetoxibenzoílo, o ácido 2,4,6-trimetoxibenzóico ou a 3-nonen-2-ona (BARKER e SETTINE, 1979). A descrição da síntese do olivetol através da condensação aldólica entre compostos carbonilados pareceu uma possibilidade viável para os nossos estudos, onde a condensação do hexanal com acetona gera a 3-nonen-2-ona, que é convertida no 6-pentil-2- hidróxi-4-oxo-ciclohex-2-eno-1-carboxilato e por fim a obtenção do olivetol (FOCELLA e TEITEL, 1977).
Material e métodos
Preparação da 3-nonen-2-ona: dentro de um freezer horizontal à -20 °C, um funil de separação contendo uma mistura de acetona (0,8 mol; 58,8 mL) e hexanal (0,4 mol; 49,2 mL) foi adicionada por gotejamento a um balão contendo uma mistura de acetona (1,2 mol; 88 mL) e solução de NaOH 2,5 M (20 mL), por 29h sob agitação. Em seguida, neutralizou-se a reação adicionando- se 13 mL de HCl conc. e procedeu-se a extração com 3 porções de 20 mL de AcOEt, recolhendo-se a fase orgânica que foi seca com Na2SO4 anidro, filtrada e evaporada sob vácuo. A reação foi companhada por CCF e para purificação realizou-se cromatografia em coluna utilizando-se 149 g de sílica-gel (80-230 mesh) em hexano, aplicando-se 3,16g do produto obtido após evaporação. Utilizou-se a seguinte ordem de eluentes: hexano, uma mistura de hexano e acetato de etila (1:1) e acetato de etila. Foi feito CCF das frações coletadas constatando-se que o produto desejado se encontrava nas ultimas frações. As frações com o produto desejado foram reunidas, evaporadas sob vácuo e analisadas por Espectroscopia de Infravermelho (IV) e por Ressonância Magnética Nuclear (RMN).
Resultado e discussão
Obteve-se um líquido de coloração alaranjada e após o processo de evaporação
realizado para a retirada do excesso de acetona da reação, a coloração mudou
para um alaranjado mais intenso. Com a evaporação do solvente a cor foi
alterada para um vermelho escuro.
Após a cromatografia em coluna o produto contido nas últimas frações
coletadas apresentou coloração amarelada. Quando evaporado o eluente, restou
um material oleoso de cor amarelada. Através das análises de RMN e IV, foi
possível observar o aparecimento de sinais que indicam fortemente a
identidade 3-nonen-2-ona. Na fase de cima do espectro de DEPT 135 verifica-
se a presença de 4 sinais, sendo 2 sinais bastante desblindados (148,13 e
130,41 ppm), compatíveis com os sinais de CH da ligação olefínica da 3-
nonen-2-ona e dois sinais mais blindados em 25,82 e 13,07 ppm,
correspendentes às metilas. Na fase de baixo do espectro verifica-se a
presença de 4 sinais na região mais blindada, relativos aos metilenos dessa
molécula. Como sabido, o sinal da carbonila é suprimido do espectro de DEPT.
No espectro de DEPT 90, verifica-se que só dois sinais permaneceram, o que
condiz com os únicos sinais de CH olefínicos desta molécula.
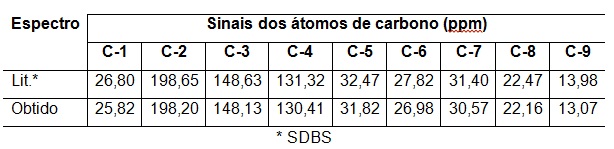
Tabela 1- Comparação entre os espectros de RMN de 13C da 3-nonen-2-ona.
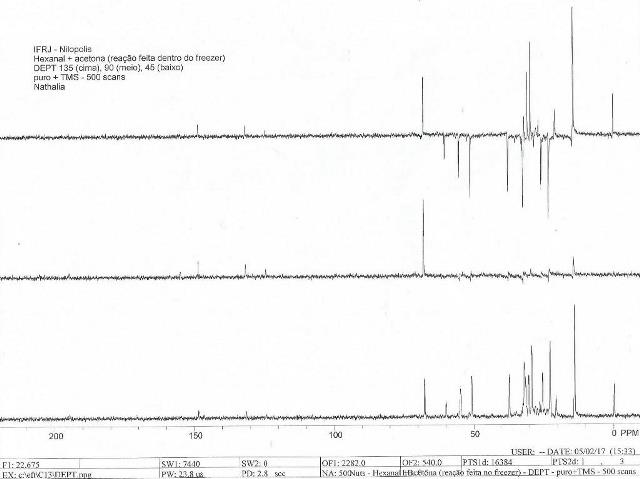
Figura 1: Espectro DEPT do produto obtido.
Conclusões
Com base nos resultados obtidos a partir dos procedimentos realizados é plausível afirmar que o produto obtido seja a 3-nonen-2-ona, demonstrando assim a eficiência do procedimento realizado visando à obtenção do olivetol.
Agradecimentos
Agradeço ao Instituto Federal do Rio de Janeiro Campus Nilópolis por disponibilizar o local, a CNPq ao apoio financeiro e ao meu orientador Flávio Violante.
Referências
ANAND, R.C; RAJAN H. A practical syntheses of Olivetol. Bul. Chem. Soc. Jpn. v.56, p.1889-1990, 1983. (http://www.journal.csj.jp/doi/abs/10.1246/bcsj.56.1889. Acesso em: 15 jun. 2017).
BARKER, S.A.; SETTINE, R.L. The synthesis of olivetol. Trimethylsilation as a protective group during grignard reactions. Organic preparations and procedures int., v.11, n.2, p.87-92, 1979.
FOCELLA, A.; TEITEL, S. A simple and practical synthesis of olivetol. J. Org. Chem., v.42, p.3456-3457, 1977.
SDBS - Spectral Database for Organic Compounds. Disponível em: http://sdbs.db.aist.go.jp/sdbs/cgi-bin/cre_index.cgi. Acesso em julho de 2017.
































