Avaliação de sistema de microextração em fase sólida para extração de rotenona em timbó (Ateleia glazoviana Baill) e posterior identificação por ESI-ToF-MS
ISBN 978-85-85905-21-7
Área
Iniciação Científica
Autores
Pazinatto, B.M. (IFRS) ; Kreling, B.E. (IFRS) ; Theisen, M.C. (IFRS) ; Campos, B.C. (IFRS) ; Montezano, E.M. (IFRS) ; Iop, G.D. (UFSM) ; Santos, D. (UFSM) ; Cruz, S.M. (IFRS)
Resumo
Timbó é nome pelo qual são conhecidas na Amazônia diversas plantas de cultura pré-colombiana, ainda hoje utilizadas pelos índios. Possui caráter inseticida devido à presença de macromoléculas orgânicas, sendo a principal delas a rotenona. Há muitas espécies de timbó, contudo, a Ateleia glazioviana Baill é a espécie de timbó de maior ocorrência no oeste e meio oeste de SC e, também, no noroeste do RS, contudo no IFRS - Campus Ibirubá. O objetivo deste trabalho foi identificar a presença de rotenona nas plantas de timbó Ateleia glazoaviana Baill nos extratos obtidos por microextração em fase sólida (SPME) em diferentes épocas do ano.
Palavras chaves
Metodologia; microextração; rotenona
Introdução
Os inseticidas botânicos são produtos derivados de plantas ou parte delas, podendo ser o próprio material vegetal utilizado de várias formas. Na forma de pó, após secagem do material ao ar livre ou em estufa com circulação de ar, o material é moído até ser obtido um pó, por extração aquosa, geralmente é mais demorado, pois passa por uma série de etapas, como secagem, moagem, imersão em água, agitação, repouso e filtragem ou por extração com solventes orgânicos. Antes da Segunda Guerra Mundial, o pó das raízes dos timbós era um dos produtos de exportação da Amazônia. Nesse período, diversos produtos eram feitos a partir da extração da rotenona como, o combate às pragas da lavoura, insetos de hábitos domésticos e, também, no combate aos ectoparasitas de animais domésticos. No entanto, desde o advento dos inseticidas sintéticos durante a segunda guerra, alguns dos quais diversificados em suas fórmulas de fabricação, passaram a apresentar índices tão elevados de toxicidade que deixaram de serem chamados defensivos agrícolas e, hoje são chamados de agrotóxicos. Atualmente, em consequência do desenvolvimento de estudos e pesquisas, os timbós voltaram a despertar interesse, principalmente, pelas possibilidades de se tornarem sucessores eficientes dos produtos sintéticos. No presente trabalho a microextração em fase sólida (SPME) é proposta a identificação de rotenona, em plantas de timbós presentes no IFRS-Campus Ibirubá.
Material e métodos
Um sistema de SPME foi adaptado no laboratório a partir dos materiais disponíveis. Para isso, foi montado um sistema que consiste em uma bomba de vácuo acoplada a um balão de fundo redondo de 250 mL, no qual foram colocados cartuchos (seringas) contendo 500 mg de amostra. Foram avaliados os seguintes parâmetros: eluente utilizado, temperatura e quantidade de eluente, massa de amostra e composição do cartucho. A extração foi feita em 4 etapas: i) ativação do adsorvente a partir da introdução de 5 mL do eluente na seringa, ii) condicionamento do adsorvente com 5 mL do eluente adequado, iii) introdução da amostra, iv) introdução do eluente em volumes variáveis de 10 mL e 15 mL e v) coleta do analito. Com base na literatura, os solventes utilizados foram etanol 95% (Vetec, Brasil) e propanona 99,5% (Mazzochini, Brasil). Como agente adsorvente, foi utilizado sílica gel (Neon, 4-8mm). Após avaliação do método de preparo de amostra foi feita a identificação do composto nos extratos por cromatografia a líquido por tempo de vôo acoplado a espectrometria de massas (ESI-ToF-MS). Para identificação, foram utilizados os seguintes parâmetros: capilaridade (2,5 kV), voltagem do cone (25 V), cone extrator (4 V), gás de dessolvatação (400 L h-1), gás do cone (10 L h-1), temperatura de dessolvatação (400 ºC) e temperatura da fonte (150 °C).
Resultado e discussão
Inicialmente, de maneira qualitativa, foi feita a identificação da molécula da
rotenona, através de indicadores. Para isso, foi aplicado o teste de Durham,
no qual cerca de 50 mg de amostra (em pó, já cominuídas), foram colocados em
placa de petri. Em seguida, foram adicionados 1 mL de ácido nítrico (HNO3)
concentrado (65%, d = 1,18 mL g-1) e, após o aparecimento da coloração
amarelada, 1 ml de hidróxido de amônio (30%, d = 0,91 mL g-1),
vagarosamente, até o aparecimento da coloração verde-azulada. Essa coloração
indica a presença de rotenona na amostra. Contudo, este método não permite a
extração da rotenona, apenas a identificação qualitativa. Com o objetivo de
extrair o composto foi feita a extração de modo convencional, com agitação
manual e funil de decantação. No entanto, para as folhas coletadas na
primavera não houve a identificação do composto no extrato. O espectro de
massas obtido por ESI-ToF-MS pode ser observado na Figura 1. Sendo assim, a
técnica de SPME foi avaliada para a extração da rotenona. Dessa maneira, foi
confeccionado um sistema de microextração montado com materiais disponíveis no
laboratório, conforme descrito em materiais e métodos. As soluções obtidas
após as extrações pelo método de SPME foram introduzidas no equipamento de
ESI-ToF-MS. Pode ser observado no espectro obtido (Figura 2) que após o método
de preparo de amostras (SPME) foi possível identificar a presença do composto
de rotenona nas amostras de timbó coletadas na primavera e no verão.
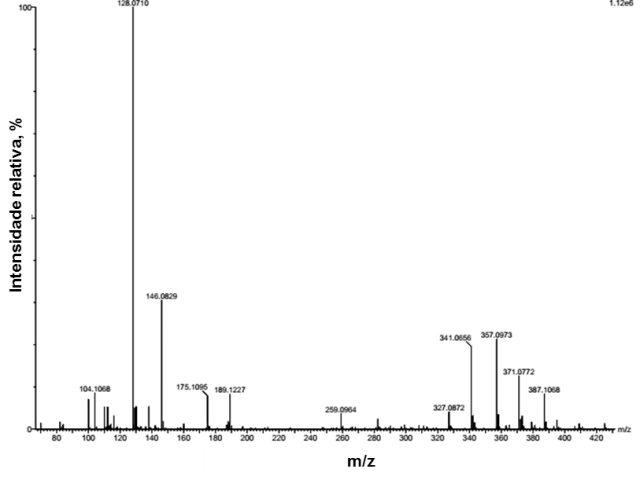
Espectro de massas obtido após extração convencional da amostra de timbó.
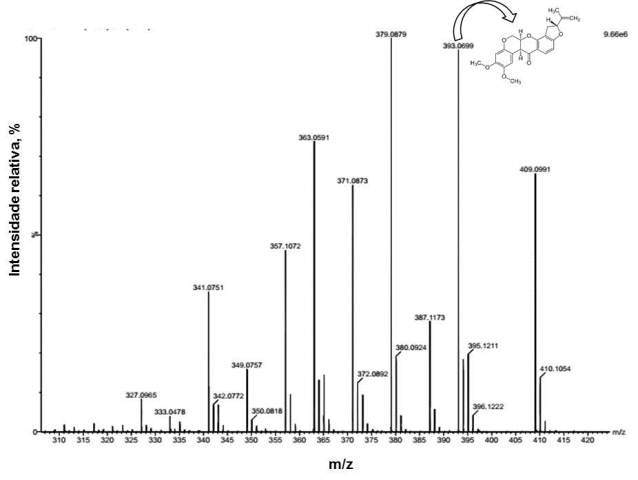
Espectro de massas obtido após extração da rotenona utilizando SPME.
Conclusões
De acordo com os espectros obtidos foi possível identificar a presença da rotenona (P.M.= 394,41 g/mol) no fragmento M+1 = 393,0699 utilizando como solvente a propanona. Desta forma, com o desenvolvimento desta metodologia, foi possível a extração e identificação da molécula de rotenona em extratos de timbó Ateleia glazioviana Baill.
Agradecimentos
A Universidade Federal de Santa Maria pelo suporte e, também, ao programa PIBIC- EM/IFRS/CNPq pela bolsa concedida.
Referências
1. Lima, R.R. Informações sobre duas espécies de timbó: Derris urucu, Macbride e Derris nicou Macbride, como plantas inseticidas. Belém: Embrapa-CPATU, 1987.
2. COSTA, J. P. C. da; ALVES, S. de M.; BELO, M. Teores de rotenona em clones de timbó (derris spp. Fabaceae) de diferentes regiões da Amazônia e os seus efeitos na emergência de imagos em Musca domestica L. Belém, PA: ACTA AMAZONICA, 1999.
3. Costa, J.P.C.; BELO, M.; BARBOSA, J. C. Efeitos de espécies de timbós (Derris spp.: Fabaceae) em populações de Musca domestica L. Anais da Sociedade Entomológica do Brasil, Londrina - PR, v. 26, n. 1, p. 163-168, 1997.
4. VIEGAS JR., C. Terpenos com atividade inseticida: uma alternativa para o controle químico de insetos. Química Nova, v.26, n. 3, p. 390-400, 2003.
5. MENEZES, E. L. A. Inseticidas botânicos: seus princípios atiivos, modos de ação e uso agrícola. (in:EMBRAPA, documentos 205). Rio de Janeiro: Seropédica, 2005.
6. Lorenzi, H. Árvores brasileiras: manual de identificação e cultivo de plantas arbóreas nativas do brasil. Nova Odessa: Ed. Plantarium, 1992. 352p.
7. Longhi, R. A. Livro das árvores: árvores e arvoretas do sul. 2.ed. Porto Alegre: l & PM, 1995. 176p.
8. JARDIM, I. C. S. F. Extração em Fase Sólida: Fundamentos Teóricos e Novas Estratégias para Preparação de Fases Sólidas. Campinas - SP, Universidade Estadual de Campinas, Instituto de Química: Scientia Chromatographica Vol.2, N°1, 13-25, 2010.
































