Efeito do pH na cinética de oxidação da hemoglobina de Glossoscolex paulistus (HbGp).
ISBN 978-85-85905-21-7
Área
Iniciação Científica
Autores
Simões, Y.S. (UNIFESSPA) ; Silva, R.P. (UNIFESSPA) ; Oliveira, T.M.B.F. (UNIFESSPA) ; Carvalho, F.A.O. (UNIFESSPA)
Resumo
No presente estudo, o mecanismo de auto-oxidação da HbGp foi analisado em meio alcalino por espectroscopia no UV-VIS. No pH 8,0 e 9,0 o processo é lento e ocorrem em uma única etapa, cuja constante de velocidade no pH é 1,61 x 10-4 s-1. Todavia, nos valores de pH 9,5 e 10,0 este processo ocorre em duas etapas: um processo rápido com constante de velocidade (k1), provavelmente é devido a oxidação dos íons ferro do grupo expostos ao solvente e uma etapa mais lenta (k2) associado a auto-oxidação do ferro de subunidades parcialmente enovelada, como o trímero. Os resultados obtidos mostram que a velocidade do processo de auto-oxidação da HbGp é fortemente dependente da concentração de H3O+ no meio e corroboram estudos anteriores que reportam a estabilidade da HbGp em diferentes valores de pH.
Palavras chaves
Hemoglobina; pH alcalino; Cinética
Introdução
A hemoglobina extracelular gigante de Glossoscolex paulistus (HbGp) é extraída de um anelídeo, que pertence à classe Oligochaeta e à família Glossoscolecidae, nativo das cidades de Rio Claro e Piracicaba, estado de São Paulo (SANTIAGO et al, 2008). A estrutura quaternária da HbGp é formada por 180 cadeias polipeptídicas dispostas em duas camadas hexagonais, sendo 144 cadeias globínicas, que possuem com grupo heme e 36 cadeias linkers desprovidas deste grupo prostético. Cada camada é constituída por seis unidades ((abcd)3L3, protômeros) de massa molecular 1/12 da molécula íntegra (CARVALHO et al, p. 183-193, 2011; HARNOIS et al, 2009). Nos últimos anos, as hemoglobinas extracelulares têm sido estudadas devido ao alto potencial para aplicações na área biomédica. Atualmente dois produtos, o HEMO2lifeH que é usado em meios clínicos para conservação de órgãos e HEMOXYCarrierH como carreador de oxigênio universal. Outrossim, esta classe de proteína possui propriedades singulares como, alta estabilidade oligomérica, resistência à auto-oxidação e alta cooperatividade quando comparada a hemoglobinas de mamíferos (ROUSSELOT et al, p. 333-345, 2006). Estudos anteriores têm mostrado que a HbGp é bastante estável em valores de pH em torno de 7,0 permanecendo com diâmetro hidrodinâmico em torno de 27 nm e banda de Soret em 415 nm característicos da proteína nativa, enquanto em pH alcalino a HbGp sofre dissociação oligomérica em diferentes subunidades (SANTIAGO et al, 2008 e 2010). No entanto, pouco é conhecido sobre o mecanismo cinético de oxidação, dissociação e desnaturação da HbGp. O presente trabalho tem por objetivo estudar a cinética de oxidação da HbGp em pH alcalino, a fim de fornecer informações importantes sobre o mecanismo de “unfolding” e “re-unfolding” da macromolécula.
Material e métodos
A HbGp foi extraída e purificada, como reportado na literatura (SANTIAGO et al, 2010). Para o preparo das amostras em diferentes valores de pH foram preparados um estoque 3,0 mg/mL em tampão tris-HCl 0,1 mol/L, pH 7,0 a partir de um estoque concentrado de proteína 24,0 mg/mL, e estoques do mesmo tampão nos valores de pH 8,01; 9,01; 9,5 e 10,15. As amostras da HbGp 0,2 mg/mL nos diferentes valores de pH foram preparadas adicionando alíquotas dos estoques de proteína (3,0 mg/mL) e dos diferentes tampões num volume final de 2,0 mL. As cinéticas de auto-oxidação da HbGp em função do pH foram realizadas num espectrofotômetro UV-VIS da Biospectro, monitorando a variação da absorbância da amostra no comprimento de onda 414 nm em função do tempo. Todos os experimentos foram realizados a 25 oC em triplicatas usando uma cubeta de quartzo de caminho óptico de 1 cm. As constantes de velocidades nos diferentes valores de pH foram obtidas a partir de ajustes dos dados experimentais no programa origin 8.0., utilizando a combinação de cinéticas de primeira ordem com diferentes constantes de velocidades, que caracterizam os vários processos resultantes da interação da proteína em meio alcalino. A equação usada nas análises dos dados é mostrada a seguir: A = ∆A1exp(-k1*t) + ∆A2exp(-k2*t) + A0 (Equação 1) onde k1 e k2 são, respectivamente, as constantes de velocidade de primeira ordem para os processos de oxidação rápido e lento. ∆A1 e ∆A2 são as variações de absorbância e A0 é a absorbância no infinito.
Resultado e discussão
O estado de oxidação da HbGp, bem como os parâmetros estruturais da forma
nativa foram avaliados a partir das análises do espectro de absorção óptica
no UV-VIS e da distribuição de partículas. O espectro da HbGp purificada
apresenta três bandas: centradas 415nm, 540nm e 575nm, que são
características da HbGp nativa.
A Figura 1 mostra a variação da absorbância (abs) da HbGp em função do tempo
em diferentes valores de pH alcalino. Em pH 8,0 os valores de abs decrescem
lentamente, sugerindo pequenas alterações no grupo heme. CARVALHO 2013,
mostra que no pH 8,0, a oxi-HbGp encontra-se parcialmente dissociada, porém
a proteína integra com 88% é a espécie majoritária na solução. Todavia, os
valores de pH 9,0 a 10,1 induzem um intenso decréscimo nos valores de abs no
tempo, pois o aumento do pH favorece a auto-oxidação da proteína. O aumento
na velocidade do processo é devido à exposição do grupo heme ao solvente,
devido a intensa dissociação e desnaturação da HbGp em meio fortemente
alcalino.
As constantes de velocidades (k) em função do pH são mostradas na Tabela 1.
No pH 8,0 a taxa de variação de abs é tão lenta, que no intervalo de tempo
monitorado não foi possível obter os valores de k do processo. Entretanto,
no pH 9,0 um decaimento mono-exponencial é obtido com constante de
velocidade de (1,61 ± 0,02) x 10-4 s-1. Este valor corrobora a baixa
exposição do grupo heme ao solvente, pois no pH 9,0 a HbGp integra é
predominante em solução. Nos valores mais altos de pH a HbGp está
dissociada, e o processo de oxidação ocorre em duas etapas: um processo
rápido atribuído a oxidação do monômero com k1 entre (2,1 ± 0,1 e 320 ± 14)
x 10-4 s-1, e uma etapa lenta devido a oxidação do trímero cujo valores de
k2 são (0,75 ± 0,05) x 10-4 s-1 no pH 9,5 e (30 ± 1) x 10-4 s-1 no pH 10,1.
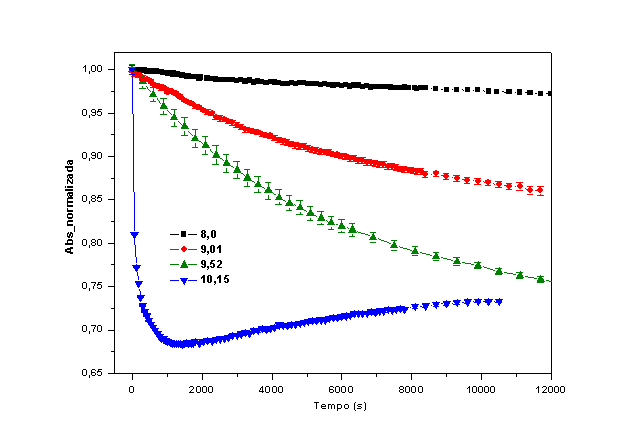
Curvas cinéticas da auto-oxidação da oxi-HbGp em meio alcalino nos valores de pH indicados.

Conclusões
O processo de auto-oxidação da HbGp em função do pH depende do estado oligomérico da HbGp. Em condições brandas, pH 9,01, a cinética de oxidação ocorre em uma única etapa. Em valores de pH muito alcalino, 9,50 e 10,15, onde a proteína está completamente dissociada e desnaturada, o mecanismo de oxidação é caracterizado por duas etapas: uma etapa rápida associada à oxidação de grupos heme expostos ao solvente, e uma etapa muito lenta atribuída à auto-oxidação do ferro de subunidades parcialmente enoveladas. Em suma o mecanismo de oxidação depende do grau de enovelamento da HbGp.
Agradecimentos
A Fundação Amazônia de Amparo a Estudos e Pesquisa do Pará (Fapespa) pela bolsa concedida. Ao laboratório de Sedimentologia do IGE-UNIFESSPA.
Referências
CARVALHO, F.A.O.; SANTIAGO, P.S.; BORGES, J.C.; TABAK, M. Intern. J. Biol. Macrom., 48:183-193, 2011.
CARVALHO, F.A.O.; CARVALHO, J.W.P.; Alves, F.R.; Tabak, M. Intern. J. Biol. Macrom., 59: 333-341, 2013.
HARNOIS, T.; ROUSSELOT, M.; ROGNIAUX, H.; ZAL, F. Artif. Cell. Blood. Sub., 37:106-116 (2009).
SANTIAGO, P.S.; MOURA, F.; MOREIRA, L.M.; DOMINGUES, M.M.; SANTOS, N.C.; TABAK, M. Biophys. J., 94:2228-2240, 2008.
SANTIAGO, P.S.; CARVALHO, F.A.O.; DOMINGUES, M.M.; CARVALHO, J.W.P.; SANTOS, N.C.; TABAK, M. Langmuir, 15;26 (12):9794-801, 2010.
































