CONSTITUINTES QUÍMICOS DO FUNGO ENDOFÍTICO Fusarium udum
ISBN 978-85-85905-21-7
Área
Iniciação Científica
Autores
Bezerra de Sousa, D. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Mendes do Nascimento, T. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Rufino Areal, M.V. (UNIVERSIDADE FEDERAL DO CEARÁ) ; de Gois Martins, T. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Torres ávila Pimenta, A. (UNIVERSIDADE FEDERAL DO CEARÁ) ; Sousa Lima, M.A. (UNIVERSIDADE FEDERAL DO CEARÁ)
Resumo
O fungo endofítico Fusarium udum, responsável pela murcha em espécies de Crotalaria e feijão-guandu,foi cultivado nos meios de cultura MPD por 25 dias e BDL por 28 dias. Cromatografia do extrato AcOEt obtido a partir da extração do meio líquido do cultivo em MPD levou ao isolamento do tirosol (1), ácido fusárico (2) e monaspilosina (3). Cromatografia do extrato AcOEt obtido através do cultivo em BDL, forneceu a ciclo (L-Pro-L-Leu) (4) e o triptofol (5). A adenosina (6) foi isolada através do extrato obtido a partir da extração do micélio em metanol. O isolamento dos metabólitos secundários (1-6) foi realizado através do uso de técnicas cromatográficas, e a caracterização estrutural foi possível através de ressonância magnética nuclear (RMN).
Palavras chaves
Fusarium udum; Fungo endofítico; Metabólitos secundários
Introdução
Fungos endofíticos habitam o interior dos tecidos vegetais e se encontram nos mais diversos ambientes, desde oceanos, florestas tropicais e ambientes desérticos, ocupando das raízes às folhas das plantas (KHARWAR et al., 2011). Segundo Ploetz (1990, apud MELO, 2014), o gênero Fusarium ocupa a terceira posição entre os gêneros de fungos com maior número de espécies que podem causar doenças em plantas, animais domésticos e humanos, devido a ação de suas micotoxinas. F. udum é responsável pela murcha em espécies de Crotalariae no “feijão- guandu” (Cajanuscajan), relatada pela primeira vez em 1906, na Índia, havendo relatos da doença em outros países asiáticos, na América do Sul bem como no continente africano. A contaminação do microrganismo se dá pela invasão do parasita que habita o solo e penetra na planta através das raízes ou ferimentos no caule, colonizando o sistema vascular do hospedeiro. As folhas apresentam-se amareladas e murchas, e as faixas roxas observadas no caule ocorrem devido ao comprometimento do xilema (KARIMI et al., 2012). Os relatos na literatura acerca das grandes perdas na agricultura causadas por espécies do gênero Fusarium, bem como as doenças relacionadas à ingestão de metabólitos secundários tóxicos biossintetizados por estes micro- organismos, aliado ao fato de que F. udum ainda não foi investigado,justificam o estudo químico desta espécie.
Material e métodos
Fusarium udum (código UFCM0439) foi isolado de Crotalaria paulinea e cedido a partir da Coleção de Culturas de Fungos de Plantas Tropicais do Laboratório de Micologia da Universidade Federal do Ceará- UFC. As cepas encontram-se preservadas segundo o método Castellani (CASTELLANI, 1963). O cultivo de F. udumfoi realizado no Laboratório de Micologia da UFC, por um fotoperíodo de 12 horas no claro, 12 horas no escuro e temperatura de 28- 33°C. O fracionamento dos extratos foi efetuado em cartucho de sílica C18-ODSS trata Phenomenex®, e a purificação das frações por CLAE foi realizada em equipamento SHIMADZU LC-20AT, sistema de bombeamento ternário de alta pressão e detector UV-visível com arranjo de diodo SHIMADZU SPD-M20A e forno termostático contendo a coluna metálica com recheio de sílica. Os espectros de RMN de 1H e 13C foram obtidos em equipamento Brucker® DPX 300 e 500 MHz, no Centro Nordestino de Aplicação e Uso da Ressonância Magnética Nuclear (CENAUREMN) da UFC, utilizando-se os solventes CD3ODe DMSO-d6deuterados da Cambridge Isotope Laboratories.
Resultado e discussão
F. udum foi cultivado em 4 L de meio MPD distribuídos em 4 erlenmeyers de 2
L. Após 25 dias de incubação, efetuou-se a filtração a vácuo para a
separação do micélio do meio. O meio líquido foi submetido à extração com
AcOEt e a fase orgânica foi destilada em evaporador rotativo para obtenção
de 274,2 mg de extrato bruto que, após purificado por CLAE, levou ao
isolamento dos compostos 1 (6,6 mg), 2 (8,0 mg)e 3 (1,2 mg). O composto 1
foi caracterizado como o tirosol (C8H10O2) (PARK et al., 2011), o composto 2
foi caracterizado como o ácido fusárico (C10H13NO2) (TUNG et al., 2016)e o
composto 3 trata-se da monaspilosina (C16H16O3) (CHENG et al., 2008).
Para o cultivo do microrganismo em meio BDL foram necessários de 80
erlenmeyers de 500 mL para distribuir os 16 L de meio. Após 28 dias de
incubação, adotou-se o mesmo procedimento supracitado, para a obtenção de
550,3 mg do extrato AcOEt, que, após sucessivas cromatografias, levou ao
isolamento dos compostos 4(5,0 mg) e 5(1,5 mg). O composto 4, foi
caracterizado como a ciclo (L-Pro-L-Leu) (C11H18N2O2) (FURTADO et al., 2005)
e o composto 5 foi caracterizado como o triptofol(C10H11NO) (ELLEUCH et al.,
2010).
O micélio foi submetido à extração com metanol por 24 horas, e o extrato
obtido(6,3 g)após evaporação do solvente, foi submetido à CLAE para a
obtenção do composto 6(4,3 mg), caracterizado como adenosina(C10H13N5O4)
(ABOU-HUSSEIN et al., 2007). Os resultados dos espectros de RMN, e Massa ,
bem como suas formas estruturais encontram-se nas Tabelas 01 e 02.
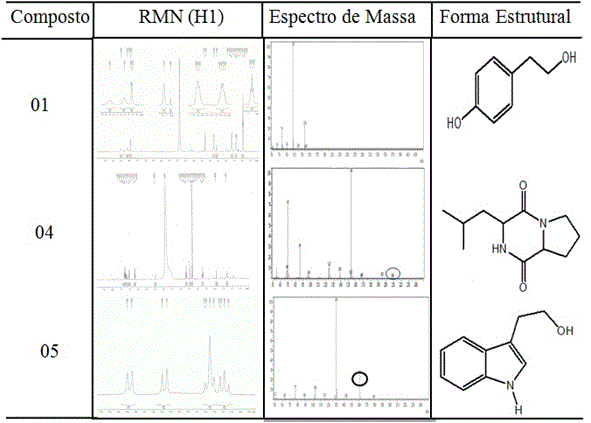
Espectros de RMN e massa dos compostos: tirosol (01), ciclo (L-Pro-L-Leu) (04) e o triptofol (05) e suas respectivas formas estruturais.
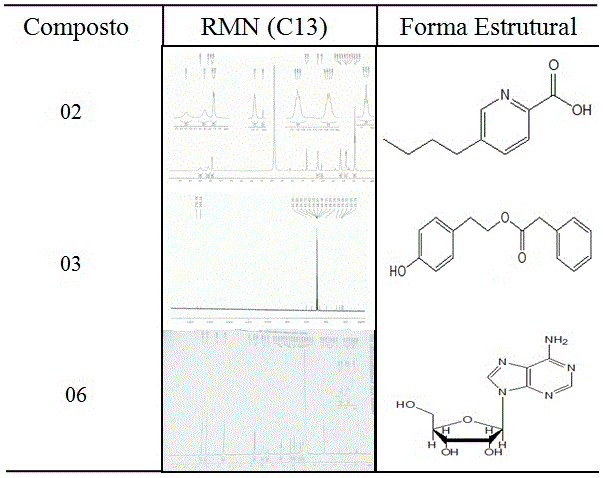
Espectros de RMN e formas estruturais dos compostos: ácido fusárico (02), monaspilosina (03) e adenosina (06).
Conclusões
O estudo de prospecção química de F. udum foi realizado através do cultivo nos meios de cultura MPD (malte, peptona e dextrose) e BDL (batata, dextrose, extrato de levedura), levando ao isolamento de 6 metabólitos secundários: tirosol, ácido fusárico, ciclo (L-Pro-L-Leu), monaspilosina, triptofol e adenosina. Os resultados obtidos contribuem para o conhecimento químico do gênero Fusarium, econfirmam o potencial químico de fungos endofíticos, que ainda se apresentam como uma fonte pouco explorada.
Agradecimentos
Os autores agradecem aos órgãos de fomento CNPq e CAPES pelas bolsas e auxílios recebidos.
Referências
ABOU-HUSSEIN, D. R.; BADR, J.; YOUSSEF, D.Nucleoside constituents of the egyptian tunicate Eudistoma laysani. Natural Product Sciences, v. 13, n. 3, p. 229–233, 2007.
CASTELLANI, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia et MycologiaApplicata, v. 20, n. 1–2, p. 1–6, 1963.
CHAPLA, V. M. Estudo químico e biológico do fungo endofítico Phomopsissp. isolado da Senna spectabilis. 2010. 176 f. Dissertação (Mestrado em Química) - Universidade Estadual Paulista, Araraquara, 2010.
CHAPLA, V. M.; BIASETTO, C. R.; ARAUJO, A. R. Fungos endofíticos : uma fonte inexplorada e sustentável de novos e bioativos produtos naturais. Revista Virtual de Química, v. 5, n. 3, p. 421–437, 2013.
CHENG, M.-J.; WU, M.-D.; CHEN, I.-S.; YUAN, G.-F. Secondary metabolites from the mycelia of the fungus MonascuspilosusBCRC 38072. Chemical and Pharmaceutical Bulletin, v. 56, n. 3, p. 1205–1210, 2008.
ELLEUCH, L.; SHAABAN, M.; SMAOUI, S.; et al. Bioactive secondary metabolites from a new terrestrial Streptomyces sp. TN262. Applied Biochemistry and Biotechnology, v. 162, n. 2, p. 579–593, 2010.
FURTADO, N. A. J. C.; PUPO, M. T.; CARVALHO, I.; et al. Diketopiperazines produced by an Aspergillus fumigatus brazilian strain. Journal of the Brazilian Chemical Society, v. 16, n. 6, p. 1448–1453, 2005.
GHANNAM, I. A. Y.; ROAIAH, H. F.; HANNA, M. M.; EL-NAKKADY, S. S.; COX, R. J. identification, crystal structure and antitumor activity of fusaric acid from the sugarcane fungal pathogen, Fusarium sacchari. International Journal Of Pharmacy & Technology, v. 6, n. 2, p. 6528–6535, 2014.
KARIMI, R.; OWUOCHE, J. O.; SILIM, S. N. Importance and management of Fusarium wilt (Fusarium udum Butler) of pigeonpea. International Journal of Agronomy and Agricultural Research (IJAAR), v. 2, n. 1, p. 1–14, 2012.
KHARWAR, R. N.; MISHRA, A.; GOND, S. K.; STIERLE, A.; STIERLE, D. Anticancer compounds derived from fungal endophytes: their importance and future challenges. Natural productreports, v. 28, p. 1208–1228, 2011.
MELO, M. P. D. E. Espécies biológicas e filogenéticas do complexo Fusarium fujikuroi, 2014. 132 f. Tese (Doutorado em Fitopatologia) - Universidade Federal de Lavras, Lavras, 2014.
PARK, C. H.; KIM, K. H.; LEE, I. K.; et al. Phenolic constituents of Acorusgramineus. Archives of Pharmacal Research, v. 34, n. 8, p. 1289–1296, 2011.
TADPETCH, K.; CHUKONG, C.; JEANMARD, L.; et al. Cytotoxic naphthoquinone and a new succinate ester from the soil fungus Fusarium solaniPSU-RSPG227. Phytochemistry Letters, v. 11, p. 106–110, 2015. Phytochemical Society of Europe.
TUNG, T. T.; JAKOBSEN, T. H.; DAO, T. T.; et al. Fusaric acid and analogues as gram-negative bacterial quorum sensing inhibitors. European Journal of Medicinal Chemistry, v. 126, p. 1011–1020, 2016.
VIEIRA, N. C. Estudos de fungos filamentosos isolados da rizosfera de Senna spectabilis: uma exploração racional da biodiversidade molecular com potencial citotóxico e anticolinesterásico. 2016. 116 f. Dissertação (Mestrado em Química) - Universidade Estadual Paulista, Araraquara, 2016.
































