Um novo complexo de rutênio(III) com ligante pirazol-piridina: promissor protótipo contra tumor e metástase.
ISBN 978-85-85905-21-7
Área
Química Inorgânica
Autores
Souza, A.R. (IQ/UFG) ; de Noronha, L.F. (IQ/UFG) ; Rezende, M.R.M. (ICB/UFG) ; Martins, F.T. (IQ/UFG) ; Silveira-lacerda, E.P. (ICB/UFG) ; Lima, A.P. (ICB/UFG) ; Menegatti, R. (FF/UFG) ; de Souza, A.R. (IQ/UFG)
Resumo
Neste trabalho foram sintetizados e caracterizados o ligante 2-(1H-pirazol-1-il)piridine (pzpy) e o complexo análogo ao NAMI-A, mer-[RuCl3(DMSO)(pzpy)]. Os compostos foram caracterizados por análise elementar (CHNS) e espectroscopia de IV, UV/Vis e RMN de 1H, e resolvida a estrutura do mer-[RuCl3(DMSO)(pzpy)]. Estudos biológicos de citotoxicidade e teste de Scratch, foram realizados em três linhagens tumorais e uma linhagem de células normais, e comparados com o NAMI-A. O composto apresentou baixa citotoxicidade para todas as células testadas, porém os resultados do teste de Scratch, demonstram reconstituição da monocamada celular, indicando que ser promissor contra os modelos de tumor investigados, com possível atividade antimetastática.
Palavras chaves
rutênio; anticancer; antimetástase
Introdução
Desde a descoberta por Rosenberg das propriedades da cisplatina como agente terapêutico para o tratamento do câncer (ROSENBERG, et al. 1965), o desenvolvimento de novos medicamentos à base de metal despontaram como uma oportunidade adicional aos fármacos orgânicos. Assim, numerosos compostos anticâncer à base de platina (JOHNSTONE, et al. 2016), bem como outros metais de transição, como ródio (PEIXOTO, et al. 2015) e rutênio (ALESSIO, 2017) foram sintetizados e testados quanto às atividades anticarcinogênicas. Dentre estes, o rutênio é considerado a alternativa mais promissora, porque exibem uma cinética similar aos compostos de platina(II), mais sítios de coordenação e estados de oxidação estáveis, além de ser menos tóxico que a platina, uma vez que mimetizam o ferro em várias biomoléculas (ANG, et al. 2006; ANTONARAKIS, et al. 2010). Além disso, têm demonstrado atividade anticarcinogênica promissora, embora o único composto que atingiu a fase II foi o NAMI-A (HE, et al. 2008). Apesar do NAMI-A ser ativo em células tumorais in vitro e apenas uma moderada toxicidade em modelos animais, o sucesso na quimioterapia contra o câncer está ligado à sua eficácia contra metástases tumorais (BERGAMO, et al. 2015). O processo de ativação do NAMI-A depende do potencial redox Ru(III)/Ru(II) que, por sua vez, depende fortemente dos ligantes coordenados ao rutênio. Assim, para a obtenção de derivados mais ativos é importante a escolha de ligantes que module o potencial redox dos complexos. No presente trabalho, descrevemos a síntese, caracterização e a avalição citotóxica e antimetastática de um complexo de Ru(III) com o ligante pzpy análogo ao NAMI-A. O composto e o ligante foram avaliados contra três linhagens tumorais e uma linhagem de células normais e comparados com o NAMI-A.
Material e métodos
Síntese Todos os reagentes e solventes utilizados neste trabalho foram adquiridos comercialmente e utilizados sem purificação adicional. O precursor [H-DMSO]-trans-[RuCl4 (DMSO)2] (1) e [H- Im]-trans-[RuCl4(DMSO)(Im)] (NAMI-A) foram preparados pelo método descrito anteriormente (Mestroni, et al. 1998). 2-(1H-pyrazol-1-yl)pyridine, (pzpy). Para 109 mg (1,0 mmol) de 2-hidrazinopiridina, 109 mg (1,0 mmol) de 1,1,3,3-tetramethoxipropane, adicionou-se 6 mL de MeOH e 0.5 mL de HCl e aqueceu sobr refluxo por 2 h. O solvente foi retirado por evaporação em pressão reduzida e extraído por uma solução aquosa com 3 x 15 mL de CH2Cl2 . O produto foi purificado em CC (SiO2, hexane/EtOAc = 95:5). Rendimento: 113 mg, 78%. mer-[RuCl3(DMSO)(pzpy)], (2): Para 162,8 mg (0,34 mmol) de 1 e 49,4 mg (0,34 mmol) de pzpy foram adicionados 15 mL de acetona e aquecido sob refluxo por 6 h. Apos a mudança de cor de amarelo para laranja o solvente foi reduzido sob pressão reduzida a 2/3 cristalizado no freezer. Rendimento: 123 mg, 84,8%. Bioensaios Para a avaliação biológica (citotoxicidade e Scratch Test), os complexos e o ligante foram dissolvidos no mínimo de DMSO (20 mM). As soluções de DMSO foram misturadas com água e utilizada imediatamente utilização, de modo que a concentração final de DMSO nunca excedeu 0,1% (v/v). Os efeitos citotóxico do NAMI-A, 2 e pzpy das linhas celulares de Ehrlich, A549, B16-F10 foram analisados por tratamento das células com diferentes concentrações utilizando ensaios MTT. A avaliação antimetastática dos compostos foram feitas pelo teste de Scratch, onde se estudou a capacidade de reconstituição de uma monocamada celular após a raspagem. Para isso, os compostos de rutênio contra a linha B16-F10 foram testados nas concentrações 1, 10 e 100 μM para 0, 24 e 48h.
Resultado e discussão
O complexo 2 foi caracterizado por analise elementar (CHNS), difração de raios-X, método do
monocristal, e espectroscopia de IV, UV/Vis, RMN de 1H.
O modo de ligação do ligante pzpy ao centro metálicos foi estudado pela comparação de
bandas do IV do ligante livre e o complexo. O espectro IV do ligando livre é caracterizado por
fortes bandas atribuídas a vibrações de pirazol (pz) e de piridina (py) que se deslocam ou
desaparecem após a coordenação com o centro de Ru.
A estrutura cristalina do composto 2 foi resolvida no grupo pontual P21/c, com uma molécula
de acetona e um complexo na unidade assimétrica (Figura 1). A molécula do complexo consiste
em um íon de rutênio hexacoordenado por três íons cloreto meridional, uma molécula de DMSO
coordenada pelo S e uma do ligante pzpy bidentada, formando uma geometria octaédrica
distorcida.
Na avaliação de viabilidade celular para os compostos e o ligantes (NAMI-A, 2 e pzpy),
observou-se baixa citotoxicidade para a maioria dos modelos celulares testados, com valores
de IC50 (Concentração Inibitória) (> 200 μM); com exceção do modelo celular B16-F10 com
IC50 (> 100 μM). O IS (índice de seletividade) não pôde ser calculado, uma vez que a IC50 dos
compostos foram muito elevados.
No teste de Scratch, foi observado um padrão de abertura no tempo 0 em todos os compostos.
Em 48 h, para a concentração de 100 μM, observou-se uma diminuição da abertura de 55,3% ±
12,6 para o composto 2 e 53,9% ± 5,2 para o NAMI-A, demonstrando uma acentuada
reconstituição da monocamada celular, que pode ser correlacionada com a inibição da
metástase in vivo.
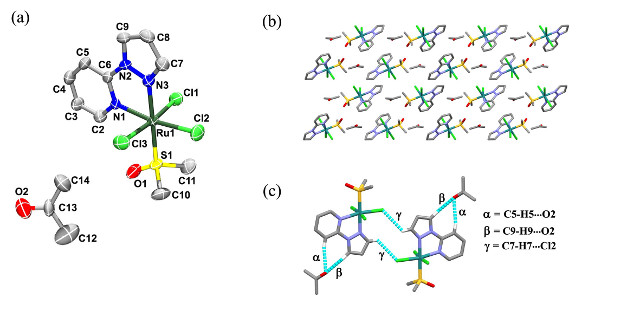
Figure 1. (a) Representação ORTEP de 2 (H são omitidos) (b) Empacotamento no plano ac. (c) Interação entre dois compostos por contato C—H•••Cl.
Conclusões
Neste trabalho foram sintetizados e caracterizados o ligante 2-(1H-pirazol-1-il)piridine, e o complexo análogo ao NAMI-A, mer-[RuCl3(DMSO)(pzpy)]. Sua estrutura cristalina foi resolvida por DRX e mostrou uma coordenação bidentada do ligante pzpy. O compostos apresentou baixa citotoxicidade para todas as células testadas, porém os resultados do teste de Scratch, demonstram uma acentuada reconstituição da monocamada celular para o composto sintetizado indicando que ser promissor contra os modelos de tumor investigados, com possível atividade antimetastática.
Agradecimentos
Os autores agradecem, PIBIC/UFG, CNPq, FAPEG e FINEP, pelo financiamento.
Referências
ALESSIO, E. Thirty years of the drug candidate NAMI-A and the myths in the field of ruthenium anticancer compounds: a personal perspective, Eur. J. Inorg. Chem., 1549-1560, 2017.
ANG, W.H.; DYSON, P.J. Classical and non-classical ruthenium-based anticancer drugs: towards targeted chemotherapy, Eur. J. Inorg. Chem., 4003-4018, 2006;
ANTONARAKIS, E.S.; EMADI, A. Ruthenium-based chemotherapeutics: Are they ready for prime time? Cancer Chemother. Pharmacol. 66, 1-9, 2010.
BERGAMO, A.; SAVA, G. Linking the future of anticancer metal-complexes to the therapy of tumour metastases, Chem. Soc. Rev. 44, 8818-8835, 2015.
FINAR, I.; HURLOCK, R. The preparation of some trinitrophenylpyrazoles. J. Chem. Soc. 3024-3027, 1957.
HE, L.; DUAN, L.; QIAO, J.; WANG, R.; WEI, P.; WANG, L.; QIU, Y. Blue-emitting cationic iridium complexes with 2-(1H-Pyrazol-1-yl)pyridine as the ancillary ligand for efficient light-emitting electrochemical cells, Adv. Funct. Mater. 18, 2123-2131, 2008.
JOHNSTONE, T.C.; SUNTHARALINGAN, K.; LIPPARD, S.J. The next generation of platinum drugs: targeted Pt(II) agents, Nanoparticle Delivery, and Pt(IV) prodrugs, Chem. Rev. 116(5), 3436-3486, 2016.
MESTRONI, G.; ALESSIO, E.; SAVA, G. WIPO Pat., WO1998000431 A1,1998.
PEIXOTO, R.C.A.; MIRANDA-VILELA, A.L.; DE SOUZA FILHO, J.; CARNEIRO, M.L.B.; OLIVEIRA, R.G.S.; DA SILVA, M.O.; DE SOUZA, A.R.; BÁO, S.N. Antitumor effect of free rhodium (II) citrate and rhodium (II) citrate-loaded maghemite nanoparticles on mice bearing breast cancer: a systemic toxicity assay, Tumor Biol.
36(5), 3325-3336, 2015.
ROSENBERG, B.; CAMP, L.V.; KRIGAS, T. Inhibition of cell division in Escherichia coli by electrolysis products from a platinum electrode, Nature 205, 698–699, 1965.
































