INVESTIGAÇÃO DA ATIVIDADE MIMÉTICA DE CATALASE DE UM COMPLEXO DE NÍQUEL(II) COM UM LIGANTE DO TIPO BASE DE SCHIFF
ISBN 978-85-85905-21-7
Área
Química Inorgânica
Autores
Dionizio, T.P. (UFRJ) ; Silva, F.P. (UFRJ) ; Moura, F.S. (UFRJ) ; Medeiros, M.E. (UFRJ) ; Casellato, A. (UFRJ)
Resumo
A demanda por fontes de água limpa tem se tornado um problema global, pois com o crescimento da população e o desenvolvimento industrial, a poluição ambiental tem se agravado. O peróxido de hidrogênio (H2O2) é um oxidante poderoso e muito versátil, entretanto, seu empregado nos processos de branqueamento nas indústrias têxtil e de papel e celulose, pode se tornar um problema ambiental, se for despejado em alta concentração nos mananciais. Entre as formas de remediação desse poluente, destaca-se a atuação de uma metaloenzima que pode possuir um ou mais íons metálicos, as catalases. Buscando uma alternativa economicamente mais vantajosa e viável, este trabalho sintetizou e caracterizou um complexo mononuclear de níquel(II) capaz de catalisar a reação de degradação do peróxido de hidrogênio.
Palavras chaves
compostos de coordenação; peróxido de hidrogênio; atividade catalase
Introdução
O H2O2 é um dos reagentes mais empregados nas mais variadas aplicações. Em adição ao controle de poluição, com ênfase no monitoramento ambiental, é empregado nas indústrias têxtil, de papel e celulose em processos de branqueamento. Tendo em vista seu grande emprego em atividades industriais, faz-se necessário o tratamento destes efluentes para reverter este quadro tão preocupante, a poluição ambiental. Entre as formas de remediação desse poluente (H2O2), destaca-se a possibilidade de uso das catalase, metaloenzimas capazes de catalisar a degradação deste contaminante. Tem sido relatada na literatura a síntese e caracterização de compostos de coordenação como modelos estruturais e funcionais para metaloenzima catalase, que funcionam como catalisadores homogêneos durante o processo de degradação do H2O2 (PESSEKI e DISMUKES, 1994; ZHANG et al., 2001; GODBOLE et al., 2005; ALVES, 2013; BUSSI, 2014). Este tipo de catálise, em que o catalisador está na mesma fase dos reagentes (sendo esta fase geralmente líquida), é atrativa pela sua alta seletividade na formação do produto desejado. Em processos industriais de grande escala, os catalisadores homogêneos são os preferidos para as reações exotérmicas, pois são capazes de dissipar o calor mais facilmente do que do leito sólido de um catalisador heterogêneo. Em princípio, toda molécula do catalisador em meio homogêneo é acessível aos reagentes, levando, potencialmente, a uma atividade muito alta (ATKINS, 2008). Assim sendo, este trabalho teve por objetivo sintetizar e caracterizar um complexo mononuclear de níquel(II) por técnicas espectroscópicas e eletroquímica e realizar um teste qualitativo para verificar a possível atividade mimética de catalase.
Material e métodos
Para preparar o ligante, adicionou-se 2-hidroxi-5-nitrobenzaldeído, solubilizado em metanol, a uma solução da etanolamina (1:1) e deixou-se sob agitação magnética por 2h. Para a síntese do complexo adicionou-se uma solução metanólica de acetato de níquel tetrahidratado à anterior (1:2) e deixou-se sob agitação magnética por 2h. A solução foi filtrada e mantida em repouso, originando um pó verde. O complexo foi caracterizado por espectroscopia no infravermelho (IV), ultravioleta-visível (UV-Vis) e voltametria cíclica (VC). A análise por VC foi realizada em uma cela voltamétrica de 3 eletrodos: de referência (ECS), de trabalho (carbono vítreo) e um contra eletrodo de platina. As análises foram feitas em atmosfera de N2 numa solução metanólica de TBAPF6 0,05 M. Para avaliar a influência do pH na degradação de H2O2 fez-se ensaios reacionais nos pH’s 3,5, 7,0 e 9,5. Foram adicionados à cubeta 1,50 mL de uma solução tampão (0,10 M), 1,20 mL de água, 0,20 mL de uma solução do complexo (10-3 M) e 0,10 mL de uma solução de peróxido de hidrogênio (10,15 M). Em seguida, foi realizado novo ensaio no meio mais ativo variando o pH de 0,5 em 0,5. Buscando avaliar a influência do efeito da concentração do substrato, um experimento similar ao anterior foi realizado alterando o volume de peróxido de hidrogênio. Para este experimento foi fixado o valor de pH, aquele em que o complexo teve maior atividade catalítica. Para os ensaios, foram adicionados a uma cubeta 1,50 mL de uma solução do tampão CHES (0,10 M), água, 0,20 mL de uma solução de complexo (10-3 M) e a solução de peróxido de hidrogênio (10,15 M). O volume de H2O2 adicionado nas cubetas 1, 2 e 3 foram, respectivamente, 1, 0,1 e 0,01 mL. A quantidade de água adicionada foi calculada a fim de completar um volume total de 3 mL.
Resultado e discussão
O espectro no IV (Figura 1.a) do complexo mostrou bandas características dos
grupos do ligante com algum deslocamento, que pode ser atribuído a maior
rigidez das ligações pela influência da ligação dos átomos coordenantes
(N,O) ao metal. Uma banda em 1662 cm-1 no espectro do ligante foi atribuída
a C=N, já para o complexo esta banda teve um deslocamento para 1647 cm-1.
A C-Ofenol em 1222 cm-1 no ligante também foi deslocada para 1105 cm-1 no
complexo. Já a δ O-Hfenol no ligante em 684 cm-1, não encontrada no
complexo, sugere a coordenação do O ao Ni.
O espectro eletrônico (Figura 1.b) apresentou uma banda por volta de 600 nm,
atribuída à transição d-d do íon Ni2+. As bandas entre 350 e 220 nm foram
atribuídas às transições intraligantes π–π* e transferência de carga do
ligante para o metal.
O estudo eletroquímico apresentou um processo redox irreversível onde ocorre
a oxidação do Ni(II) a Ni(III) em 0,7 V. Uma segunda onda em - 1,0 V vs ECS
pode ser atribuída a redução Ni(III) a Ni(II).
No ensaio de reatividade o complexo apresentou maior atividade em meio
básico (Figura 2). Verificou-se que em pHs após o 9, o complexo mostrava-se
bastante ativo no desproporcionamento do H2O2. Baseando-se nisso, escolheu-
se o pH 9,5 para realização do próximo teste, por ter apresentado aspecto
visual mais interessante.
Variando-se a quantidade de H2O2 notou-se maior desprendimento gasoso na
cubeta onde tinha a maior concentração. Segundo Bianconi (2006), nas reações
enzimáticas, a velocidade da reação aumentará com o aumento da concentração
do substrato, até um determinado ponto em que toda a enzima presente estará
combinada com o substrato na forma do complexo E-S. Neste instante tem-se a
velocidade máxima da reação e a quantidade de substrato presente não
influenciará sobre ela.
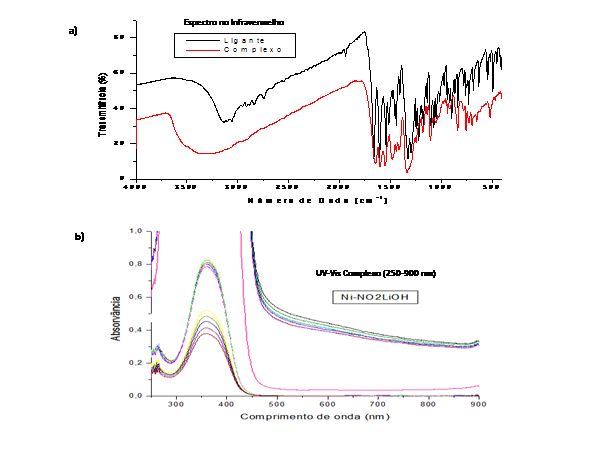
a) Espectroscopia no IV (4000 - 400 cm-1) b) Espectroscopia no UV-Vis (250 - 900 nm)

Teste variando o pH (meios ácidos, neutro e básico)
Conclusões
Foi possível sintetizar um complexo de Niquel(II) e caracterizá-lo por técnicas espectroscópicas e eletroquímica. A partir do teste qualitativo do complexo na reação de degradação de peróxido é possível sugerir que este complexo seja um catalisador promissor, possuindo atividade como mimético de catalase.
Agradecimentos
Ao Instituto de Química da UFRJ, ao CNPq e a CAPES.
Referências
ALVES, T. M. R. Síntese e caracterização de compostos de coordenação e o desenvolvimento de novos sensores amperométricos para peróxido de hidrogênio. (2013). (Dissertação de Mestrado) - Instituto de Química, UFRJ, Rio de Janeiro, 2013.
ATKINS, P., JONES, L. Princípios de Química: questionando a vida moderna e o meio ambiente. 5ª ed., Porto Alegre: Bookman, 2012.
BIANCONI, M. L. Efeito da Concentração de Substrato na Atividade Enzimática. Bioquímica Médica, UFRJ, 2006. Disponível em: <http://www2.bioqmed.ufrj.br/enzimas/concn_subst.htm>. Acesso em: 10 ago. 2017.
BUSSI, G. G. A. Investigação da promiscuidade catalítica de novos complexos metálicos. (2014). (Dissertação de Mestrado) - Instituto de Química, UFRJ, Rio de Janeiro, 2014.
GODBOLE, M.D.; KLOSKOWSKI, M.; HAGE, R.; ROMPEL, A.; MILLS, A.M.; SPEK, A.L.; BOUWMAN, E., Highly efficient disproportionation of dihydrogen peroxide: synthesis, structure, and catalase activity of manganese complexes of the salicylimidate ligand. European Journal of Inorganic Chemistry, v. 2, p. 305-313, 2005.
PESSIKI, P.J.; DISMUKES, G.C. Structural and functional models of the dimanganese catalase enzymes. Kinetics and mechanism of hydrogen peroxide dismutation. Journal of the American Chemical Society, v. 116, p. 898-903, 1994.
ZHANG, J.J., LUO, Q. H., DUAN, C.Y., WANG, Z. L., MEI, Y.H. Synthesis, crystal structure and properties of the new dinuclear manganese(III) complex: a mimic for catalase. Journal of Inorganic Biochemistry, v. 86, p. 573-579, 2001.
































