Avaliação da interação da caseína, proteína alergênica do leite, com tetraciclina, oxitetraciclina e clorotetraciclina empregando técnicas espectroscópicas.
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
de Araújo Dantas, M.D. (UFAL) ; Martins Figueiredo, I. (UFAL) ; Carinhanha Caldas Santos, J. (UFAL)
Resumo
A interação de tetraciclina (TC), oxitetraciclina (OTC) e clorotetraciclina (CTC) com caseína (CAS) foi avaliada por espectroscopia molecular. As tetraciclinas (TCs) interagem com CAS por quenching estático. A constante de ligação (Kb) variou de 0,23 a 14,0×105Lmol-1, e os parâmetros termodinâmicos foram determinados. O processo de interação foi espontâneo (ΔG < 0) e a interação foi da seguinte ordem: OTC < CTC < TC. De modo geral, o complexo supramolecular formado foi estabilizado por ligações de hidrogênio, forças de Van der Waals e eletrostáticas. As distâncias intermoleculares entre CAS e TCs foram determinadas por FRET e variaram de 5,48 a 5,52 nm. Citrato diminui a afinidade da TC com CAS, enquanto Ca(II), Fe(III) e lactose diminuem a afinidade da OTC.
Palavras chaves
caseína; tetraciclinas; técnicas espectroscópicas
Introdução
A caseína (CAS) é encontrada no leite de vaca, perfazendo 80% (m/m) do conteúdo proteico total deste alimento (RIDOUT, et al, 2015). As estruturas da CAS são formadas por micelas constituídas dos polipeptídios conhecidos como caseína α, β e κ em uma proporção molar de aproximadamente 5: 4: 1,3. Os três tipos de caseínas possuem massas moleculares semelhantes de cerca de 24 kDa (HE, et al, 2016). Esta proteína possui importante relevância na fabricação de diversos alimentos, além de ser utilizada na fabricação de produtos farmacêuticos (ETTELAIE, et al, 2014). O leite de vaca contém aproximadamente 30 proteínas potencialmente alergênicas. A alergia ao leite é causada pelas proteínas β-lactoglobulina, caseína e α-lactalbumina onde suas porcentagens de contribuição para o aparecimento de alergias são 66%, 57% e 18%, respectivamente (MICINSKI, et al, 2013). As tetraciclinas são antibióticos de amplo espectro de ação sendo empregadas na medicina veterinária na criação de animais produtores de alimentos como gado e aves para a prevenção e tratamento de doenças, e também para promover o crescimento destes animais, devido ao seu amplo espectro de ação contra bactérias (gram positivas e negativas) e seu baixo custo. No entanto, o seu uso abundante e indiscriminado pode resultar na presença de resíduos no leite, causando efeitos tóxicos, além da possibilidade de reações alérgicas (NEBOT, et al, 2014; SHALABY, et al, 2014). A conformação das proteínas do leite pode ser influenciada pela presença de antibióticos, assim como suas funções podem ser afetadas (BI, et al, 2016). Considerando as práticas inadequadas do uso das tetraciclinas na medicina veterinária, a CAS (proteína alimentar) pode ser um contaminante indireto para o consumidor, uma vez que é amplamente distribuída em diferentes formas. Neste contexto, não existe uma descrição de estudos de interação desta proteína alimentar com medicamentos de uso veterinário e investigações sobre a forma como este processo pode alterar toxicologicamente estas espécies. Várias técnicas instrumentais têm sido empregadas para avaliar interação proteína-ligante, e incluem a espectroscopia de fluorescência molecular e de absorção no UV-vis. A espectroscopia de fluorescência molecular é uma técnica amplamente utilizada no estudo das interações entre moléculas pequenas como medicamentos, inibidores, espécies tóxicas, corantes, pesticidas entre outros, e macromoléculas como proteínas, uma vez ser relativamente simples, de fácil operação e altamente sensível (MADRAKIAN, et al, 2014). Para que se possa monitorar o processo de interação, o sinal (intensidade) da fluorescência deve ser alterado (aumentar ou diminui) considerando a presença e ausência do ligante no meio proteico. Na composição das micelas de CAS a α-caseína possui dois resíduos de triptofanos, enquanto a β-caseína tem um resíduo apenas, os quais atuam como sondas fluorescentes para avaliação do processo de interação. As medidas da intensidade do sinal de fluorescência da proteína podem fornecer informações sobre a interação com moléculas pequenas, como: o mecanismo de ligação, número de sítios de ligação (estequiometria), constantes de ligação (Kb), parâmetros termodinâmicos (ΔH, ΔS e ΔG), tipo de forças intermoleculares envolvidas no processo de interação proteína-ligante, distâncias intermoleculares, entre outros (KANDAGAL, et al, 2006). A espectroscopia de absorção no UV-visível é uma técnica que pode ser utilizada para avaliar as alterações estruturais da proteína, além de analisar a formação do complexo proteína-ligante (RANJBAR, et al, 2013). Desta forma, este estudo pode ser realizado por meio do monitoramento das alterações das propriedades de absorção da proteína livre e ligada, em que se observa um aumento na intensidade da banda de absorção quando a proteína livre é associada a um ligante, o que indica a formação de um complexo proteína-ligante (YU, et al, 2014). Assim, o objetivo deste trabalho foi avaliar as interações entre CAS e TC, OTC e CTC para investigar os aspectos que regem esse processo in vitro empregando técnicas de fluorescência molecular e espectroscopia de absorção no UV-visível.
Material e métodos
Os reagentes utilizados nos ensaios foram de grau analítico de pureza. As soluções foram preparadas com água ultrapura com resistividade específica de 18,2 MΩ cm, a partir de um sistema de purificação de água (Gehaka, MS2000, Brasil). Neste estudo foi empregado tampão fosfato (10 mM, pH = 6,80). A solução estoque a 10 mM dos antibióticos, foi preparada em tampão fosfato. A concentração final destas soluções foi 1,13 mM para TC, 1,09 mM para OTC e 1,04 mM para CTC. Em seguida, as soluções estoque resultantes foram armazenadas em frascos âmbar e armazenadas sob refrigeração a 4°C. A caseína (caseína sódica de leite de vaca, Sigma) foi empregada para os estudos de interação com as tetraciclinas. A concentração da solução estoque de caseína foi determinada pela razão do sinal de absorvância a 280 nm e coeficiente de extinção molar de 32920 M-1cm-1,(AUDIC E CHAUFER, 2005) após diluição da solução na proporção de 1:5. Os reagentes CaCl2, MgCl2, FeCl3, citrato de sódio e lactose monohidratada foram empregados para os estudos de competição. A concentração da caseína foi fixada em 2,5 μM, nos estudos por fluorescência e UV-vis. A titulação espectrofluorimétrica foi realizada adicionando-se quantidades crescentes das diferentes tetraciclinas avaliadas. O intervalo de concentração máximo utilizado para as tetraciclinas foi de 1,40 a 84 µM, considerando as medidas por fluorescência no estado estacionário, fluorescência sincronizada, fluorescência 3D, transferência de energia por ressonância de fluorescência (FRET), estudo de competição, avaliação da força iônica, e influência da temperatura. Enquanto que se utilizou o intervalo de concentração máximo de 2,80 a 7,0 µM para estudos por UV-vis. As medidas espectrofluorimétricas foram realizadas em um espectrofluorímetro Shimadzu RF (modelo 5301PC, Japão) com cubetas de quartzo de 10 mm de caminho óptico equipado com lâmpada de xenônio. As medidas espectrofotométricas foram realizadas em um espectrofotômetro de varredura com feixe duplo Micronal (modelo AJX-6100PC, Brasil) equipado com cubetas de quartzo de 10 mm de caminho óptico.
Resultado e discussão
Os estudos de interação entre TC, OTC e CTC e CAS foram realizados em pH 6,8
(simulando as condições in natura do leite). Nos estudos empregando titulação
por fluorescência molecular no estado estacionário a concentração da CAS foi
fixada em 2,5 μM, enquanto variou-se o excesso das tetraciclinas em relação à
concentração inicial da proteína. Neste trabalho foram selecionadas TC, OTC e
CTC para o estudo de interação com a CAS pois são os antibióticos mais
utilizados na criação de animais destinados à alimentação humana (NEBOT, et al,
2014). Em geral, a fluorescência intrínseca de uma proteína está relacionada
aos resíduos dos aminoácidos aromáticos que são fluorescentes e atuam como
fluoróforos (ZHANG, et al, 2008). A partir dos dados obtidos por fluorescência
molecular foram calculadas as constantes de Stern-Volmer (KSV), que está
relacionado com processo de quenching (LAKOWICZ, 2006). A CAS apresentou uma
banda intensa e ampla centrada em 342 nm quando excitada a 280 nm e a adição de
tetraciclinas ao sistema levou a uma diminuição de intensidade e variação do
máximo de emissão de emissão de 342 para 339 nm. A redução da intensidade do
sinal e o deslocamento do comprimento de onda máximo foi atribuído a mudanças
conformacionais na proteína. A partir da variação da intensidade de
fluorescência na presença do ligante foi calculada a constante de ligação (Kb)
que indica a magnitude da interação entre proteína-ligante, e determinada a
estequiometria (n) do complexo macromolecular formado em diferentes
temperaturas (23, 30 e 37 ºC). Os valores máximos de Kb (Esquema 1a) para a TC
foi 14,0×105 L mol-1, para a OTC de 1,24×105 L mol-1 e
por fim, para CTC de 3,89×105 L mol-1 em 23ºC. Assim,
interação entre CAS e as tetraciclinas seguiu a seguinte ordem: OTC < CTC < TC.
O número de sítios de ligação em todas as condições foi próximo à unidade.
Estes resultados estão concordantes com a literatura, onde Bi, et al. (2016),
estudaram a interação entre TC com β-caseína e α-lactoalbumina por técnicas
espectroscópicas, obtendo valores de Kb de 1,34×104 a
4,07×104 L mol-1. Dantas, et al. (2017), avaliaram a
interação entre ovalbumina e TC, OTC e CTC, onde os valores de Kb variaram de
2,11×104 a 58,4×104 L mol-1. Por fim, foram
calculados os parâmetros termodinâmicos (ΔG, ΔH e ΔS). Considerando os valores
negativos de ∆G obtidos (Esquema 1a) o processo de interação avaliado foi
termodinamicamente espontâneo para todas as tetraciclinas. Quanto aos
parâmetros termodinâmicos (Esquema 1a), os valores de ∆H foram negativos,
indicando processos de interação exotérmica para todas as tetraciclinas. As
forças de ligação predominantes para TC e OTC são interações eletrostáticas,
enquanto para CTC as interações ocorrem preferencialmente por ligações de
hidrogênio e forças de Van der Waals (HU, et al, 2006). De acordo com os
resultados (Esquema 1a), os valores da constante de quenching (KSV) diminuíram
com aumento da temperatura independentemente do ligante. Assim, o processo de
interação entre TC, OTC e CTC e CAS ocorreu predominantemente através do
mecanismo de quenching estático com formação de complexos não-fluorescentes. A
técnica de espectroscopia de absorção UV-vis pode ser utilizada para explorar
alterações na estrutura α-hélice da proteína, detectar a formação de complexos
proteína-ligante, além de poder determinar o mecanismo de quenching (YUE, et
al, 2008). Por meio dos estudos por UV-vis (Esquema 1d) verificou-se que houve
a formação de complexos entre a CAS e as três tetraciclinas avaliadas no estado
fundamental. Estes resultados corroboram com o mecanismo de interação por
quenching estático. Para observar possíveis mudanças na polaridade do
microambiente da CAS relacionadas aos resíduos de tirosina e triptofano na
presença das tetraciclinas, foram realizados estudos por fluorescência
sincronizada. A constante Stern-Volmer (KSV) com base em ∆λ = 15 nm (Tir) e 60
nm (Trp) foi o parâmetro utilizado para esta avaliação. A partir destes estudos
observou-se que não houve variação do máximo de emissão para o resíduo de Tir
(Esquema 1b) independentemente da tetraciclina avaliada. No entanto, ocorreu
mudança no máximo de emissão da CAS (1 nm) para TC e CTC (Esquema 1b). Estes
resultados mostraram que as tetraciclinas avaliadas alteraram a estrutura a CAS
para uma conformação desdobrada quando comparada com a estrutura nativa.
Portanto, os resíduos de Trp da CAS tornaram-se expostos a um microambiente
mais polar após a interação com TC e CTC. Por fim, com base nas constantes de
KSV entre as tetraciclinas avaliadas a OTC apresentou os maiores valores. Este
resultado indica que OTC altera a conformação da CAS de forma mais eficaz do
que as outras tetraciclinas. Este fato pode estar associado ao grupo hidroxila
adicional (em comparação com TC e CTC), o que aumenta a possibilidade da
formação de ligações de hidrogênio e, portanto, o grau de interação com a
proteína que leva a mudanças em sua estrutura. Através dos estudos por
fluorescência 3D houve redução na intensidade de fluorescência dos picos 2 e 3
para a CAS independente da tetraciclina. Os gráficos de fluorescência 3D da
CAS livre e após a adição de TC (Esquema 1c) apresentou três picos. O pico 1
corresponde à dispersão de Rayleigh, que é caracterizada pela re-emissão de
radiação pelo solvente. O pico 2 corresponde a emissão dos resíduos de
triptofano e tirosina, e o pico 3 é a emissão do esqueleto do polipeptídico da
proteína. Após a adição de TC, as intensidades de fluorescência dos picos 2 e 3
foram reduzidas em aproximadamente 42 e 49%, respectivamente. A diminuição do
pico 2 indicou mudanças no microambiente dos resíduos de tirosina e
triptofano, e a redução do pico 3 mostra a modificação da estrutura nativa da
proteína. Este comportamento foi possivelmente devido a alterações na cadeia
polipeptídica da CAS, mudando assim os microambientes dos aminoácidos e o grau
original de dobramento. Finalmente, com base na fluorescência sincronizada e
3D, tornou-se evidente que houve uma alterações na estrutura nativa da CAS, as
quais mudar deste a digestibilidade da proteína até influenciar a ocorrência de
alergias. A partir dos estudos por FRET foi possível calcular as distâncias
intermoleculares entre a CAS e as três tetraciclinas estudadas, e os valores
para TC, OTC e CTC foram: 5,52; 5,50 e 5,48 nm respectivamente. A influência de
algumas espécies competidoras, incluindo Ca(II), Mg(II), citrato, Fe(III) e
lactose na interação de CAS com tetraciclinas foi avaliada. Essas espécies
foram selecionados devido a sua presença no alimento (leite de vaca). A adição
de Ca(II), Mg(II), Fe(III) e lactose aumentaram os valores da constante de
ligação Kb (Esquema 2a) entre TC e CAS, por exemplo. Quando a adição de uma
espécie aumenta a constante de ligação, isso pode indicar que houve alteração
da estrutura da proteína, e esta tornou-se mais favorável para interagir com o
ligante. A força iônica foi avaliada através da adição de diferentes
concentrações de NaCl (0-100 mM), onde foi possível observar que o aumento da
concentração do sal levava a uma diminuição de Kb independente da tetraciclina.
Os resultados (Esquema 2b) indicaram que os complexos tetraciclinas-CAS também
são estabilizados por interações eletrostáticas. Este comportamento pode estar
relacionado com às força atrativas das tetraciclinas que, em pH 6,8 tem
preferencialmete carga neutra e a micela da CAS apresenta-se superficialmente
carregada negativamente. Por fim, foram realizados estudos da influência da
temperatura de pasteurização do leite (72 ºC). A partir deste estudo observou-
se que para TC e CTC houve aumento do valor de Kb, enquanto houve redução para
OTC. Devido ao desdobramento parcial da estrutura terciária da proteína,
expondo as regiões hidrofóbicas tornando a macromolécula menos protegida,
quando comparada com a condição original.
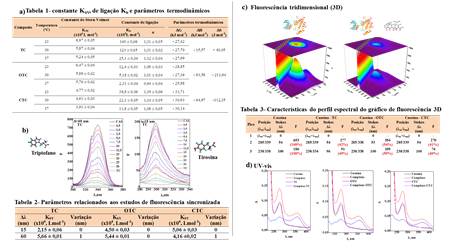
Estudos de interação Caseína e tetraciclinas.
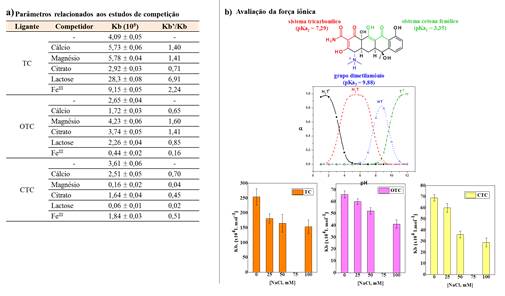
Estudo de competição e avaliação da força iônica.
Conclusões
Através desse estudo foi possível avaliar a interação da tetraciclina, oxitetraciclina e clorotetraciclina com a caseína empregando as técnicas de fluorescência molecular, e espectroscopia de absorção no UV-vis. A magnitude de interação obedeceu a seguinte ordem: OTC < CTC < TC, e o mecanismo de interação ocorreu preferencialmente por quenching estático com formação de complexos supramoleculares não fluorescentes. Os parâmetros termodinâmicos indicaram que as forças de ligação predominantes são ligações de hidrogênio, eletrostáticas e Van der Waals. Através de estudos por fluorescência 3D e sincronizada foi verificado que houve mudanças na estrutura nativa da proteína induzidas pelo processo de interação com as tetraciclinas selecionadas, o que pode potenciar reações alérgicas.
Agradecimentos
Os autores agradecem ao IQB-UFAL, CAPES, CNPq e FAPEAL.
Referências
AUDIC, J. L.; CHAUFER, B. Influence of plasticizers and crosslinking on the properties of biodegradable films made from sodium caseinate. European Polymer Journal, 41, 1934–1942, 2005.
BI, H.; TANG, L.; GAO, X,; JIA, J.; LV, J. Spectroscopic analysis on the binding interaction between tetracycline hydrochloride and bovine proteins β-casein, α-lactalbumin. Journal of luminescence, 178, 72–83, 2016.
DANTAS, M. D. A.; TENÓRIO, H. A.; LOPES, T. I. B.; PEREIRA, H. J. V.;MARSAIOLI, A. J.; FIGUEIREDO, I. M.; SANTOS, J. C. C. Interactions of tetracyclines with ovalbumin, the main allergen protein from egg white: Spectroscopic and electrophoretic studies. International Journal of Biological Macromolecules, 102, 505–514, 2017.
ETTELAIE, R.; KHANDELWAL, N.; WILKIN, R. Interactions between casein layers adsorbed on hydrophobic surfaces from self consistent field theory: k-casein versus para-k-casein. Food Hydrocolloids, 34, 236-246, 2014.
HE, Z.; XU, M.; ZENG, M.; QIN, F.; CHEN, J. Interactions of milk a- and b-casein with malvidin-3-O-glucoside and their effects on the stability of grape skin anthocyanin extracts. Food Chemistry, 199, 314–322, 2016.
HU, Y.; LIU, Y.; ZHAO, R.; DONG, J.; QU, S. Spectroscopic studies on the interaction between methylene blue and bovine serum albumin. Journal of photochemistry and photobiology A: chemistry, 179, 324–329, 2006.
KANDAGAL, P.B.; ASHOKA, A.; SEETHARAMAPPA, J.; SHAIKH, S. M. T.; JADEGOUD, Y.; IJARE, O. B. Study of the interaction of an anticancer drug with human and bovine serum albumin: Spectroscopic approach. Journal of pharmaceutical and biomedical Analysis, 41, 393–399, 2006.
LAKOWICZ, J.R. Principles of fluorescence spectroscopy. 3.ed. Baltimore: Springer, 2006.
MADRAKIAN, T.; BAGHERI, H.; AFKHAMI, A.; SOLEIMANI, M.Spectroscopic and molecular docking techniques study of the interaction between oxymetholone and human serum albumin. Journal of luminescence, 155, 218–225, 2014.
MICINSKI, J.; KOWALSKI, I. M.; ZWIERZCHOWSKI, G.; SZAREKC, J.; PIEROZYNSKI, B.; ZABŁOCK, E. Characteristics of cow's milk proteins including allergenic properties and methods for its reduction. polish annals of medicine, 20, 69–76, 2013.
NEBOT, C.; GUARDDON, M.; SECO, F.; IGLESIAS, A.; MIRANDA, J. M.; FRANCO, C. M.; CEPEDA, A. Monitoring the presence of residues of tetracyclines in baby food samples by HPLC-MS/MS. Food control, 46, 495-501, 2014.
RANJBAR, et al. Studies of the Interaction between Isoimperatorin and Human Serum Albumin by Multispectroscopic Method: Identification of Possible Binding Site of the Compound Using Esterase Activity of the Protein. The scientific world journal, 2013,4-13, 2013.
RIDOUT, M. J.; PAANANENB, A.; MAMODE, A.; LINDER, M. B.; WILDE, P. J. Interaction of transglutaminase with adsorbed and spread films of β-casein and к-caseiN. Colloids and Surfaces B: Biointerfaces, 128, 254–260, 2015.
SHALABY, A. R.; SALAMA, N. A.; ABOU-RAYA, S. H.; EMAM, W. H.; MEHAYA, F. M. Validation of HPLC method for determination of tetracycline residues in chicken meat and liver. Food chemistry, Reino Unido, 124, 1660–1666, 2011.
YU, X., LIAO, Z.; JIANG, B.; ZHENG, L.; LI, X. Study on the interaction between carbonyl-fused N-confused porphyrin and bovine serum albumin by spectroscopic techniques. Spectrochimica acta part A: molecular and biomolecular spectroscopy, 133, 372–377, 2014
YUE, Y.; ZHANG, Y.; LI, Y.; ZHU, J.; QIN, J.; CHEN, X. Interaction of nobiletin with human serum albumin studied using optical spectroscopy and molecular modeling methods. Journal of luminescence,.128, 513–520, 2008.
ZHANG, G.; QUE, Q.; PAN, J.; GUO, J. Study of the interaction between icariin and human serum albumin by fluorescence spectroscopy. Journal of molecular structure, 881, 132–138, 2008.
































