Validação de metodologia via cromatografia líquida de alta eficiência para determinação dos fármacos lamivudina e zidovudina
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Lucena, A.L.A. (UFPE) ; Ribeiro, B.G. (UFPE) ; Charamba, L.V.C. (UFPE) ; Santana, R.M.R. (UNINASSAU) ; Napoleão, D.C. (UFPE) ; Duarte, M.M.M.B. (UFPE)
Resumo
A comunidade científica mundial tem demonstrado uma crescente preocupação com a contaminação ambiental de solos, água e do ar. Dentre os tipos de indústrias que gera maior quantidade de efluentes líquidos está a farmacêutica, que mesmo após empregar tratamentos convencionais (biológicos e físico-químicos) em ETE ainda lançam em rios suas substâncias. Desse modo, se faz necessário dispor de técnicas analíticas confiáveis para determinar a presença de tais compostos em águas. A cromatografia tem sido aplicada para diferentes classes de fármacos. Este trabalho avaliou a eficiência de um método de cromatografia líquida de alta eficiência para análise dos fármacos lamivudina e zidovudina. Constatou-se que o método empregado, apresentou-se linear, preciso e confiável para o fim destinado.
Palavras chaves
Lamivudina; Zidovudina; Validação de metodologia
Introdução
A cada dia aumenta a preocupação com o número de poluentes observados em diferentes matrizes ambientais. Esses poluentes são classificados em diferentes classes, dentre as quais estão os fármacos. Estes compostos, muitas vezes, são observados em concentrações muito baixa, sendo, portanto, necessário dispor de técnicas analíticas capazes de identificá-los e quantificá-los com eficiência. Nesse ínterim, apresenta-se a cromatografia como uma técnica eficiente e segura para detectar e separar compostos das mais diferentes classes (KAZAKEVICH; LOBRUTTO, 2007; NAPOLEÃO et al., 2015). A cromatografia é provavelmente a técnica de análise mais poderosa e versátil disponível atualmente. Em um único passo pode separar uma mistura em seus componentes individuais e fornecer simultaneamente uma estimativa quantitativa de cada constituinte (SCOTT, 2003). Dentre os compostos analisados via cromatografia estão os fármacos, substâncias largamente utilizadas pela população de todo o mundo (NAPOLEÃO et al., 2015). Fármacos são amostras complexas, que quando presentes em matrizes aquáticas, por exemplo, se combinam uns com os outros, pois não são encontrados isoladamente. Diferentes classes de fármacos têm sido estudadas, com destaque para os antipiréticos, anti-inflamatórios, analgésicos, entre outros. Contudo, pouco se tem estudado sobre compostos que atuam como antirretrovirais, substâncias utilizadas no tratamento do vírus HIV, responsável pela síndrome da imunodeficiência adquirida (AIDS). Dentre os antirretrovirais utilizados estão a lamivudina e a zidovudina, compostos objeto de estudo do presente trabalho. (CORBETT, 2010). Para conseguir avaliar a presença de compostos farmacêuticos com segurança, não é suficiente apenas dispor de uma técnica analítica confiável, mas, é imprescindível que o método empregado seja confiável, preciso e exato. Para tal, tem-se utilizado da validação de metodologia para garantir que a metodologia empregada dispões de tais requisitos (RIBANI et al., 2004, NAPOLEÃO et al., 2015). A validação de um método é um processo que envolve o planejamento, desenvolvimento e aplicação de uma estratégia analítica, sendo definida como a garantia que uma metodologia analítica seja precisa, específica, reproduzível e robusta no intervalo especificado que uma amostra será analisada. Essa metodologia deve atender às exigências das aplicações analíticas, assegurando a confiabilidade dos resultados e demonstrando que um determinado método pode detectar e identificar um ou mais analitos em diferentes matrizes e instrumentos (ANVISA, 2003; SHABIR, 2003; FDA, 2015). Um método não validado leva a geração de dados analíticos não confiáveis, que podem conduzir a decisões incorretas e prejuízos financeiros irreparáveis. Enquanto um processo de validação bem definido e documentado oferece às agências reguladoras evidências objetivas de que os métodos e sistemas aplicados são adequados para um determinado uso desejado (RIBANI et al., 2004). Zaidan et al. (2013) conseguiram validar metodologia utilizando de cromatografia líquida de alta eficiência (CLAE) para detecção e quantificação de compostos fenólicos, enquanto Napoleão et al. (2015) validaram método de CLAE para determinação de fármacos como a amoxicilina. O presente trabalho teve por objetivo propor uma metodologia capaz de determinar e identificar com confiabilidade os fármacos lamivudina e zidovudina através da cromatografia líquida de alta eficiência, realizando processo de validação de metodologia.
Material e métodos
Preparação da solução estoque: foram pesados 25 mg dos princípios ativos de cada um dos fármacos (lamivudina e zidovudina) em balança analítica com precisão de 5 casas decimais. Em seguida, as massas foram dissolvidas em acetonitrila/metanol (9:1) em balão volumétrico. Construção da curva analítica: a partir da solução estoque (1000 mg/L) foram realizadas diluições para construção de duas curvas analíticas, com 7 concentrações diferentes cada. A primeira curva foi constituída dos pontos 1, 2, 3, 5, 6, 8 e 10 mg.L-1 e a segunda 10, 20, 40, 50, 60, 80 e 100 mg.L-1 A curva analítica foi construída em equipamento de cromatografia líquida de alta eficiência (HPLC-Shimadzu SS-550), equipado com a coluna ULTRA C18 operando em fase reversa (5µm; 4,6 x 250 mm) e detector espetofotométrico de ultra-violeta/visível (UV/VIS). O sistema cromatográfico utilizado no equipamento empregou uma fase móvel constituída por água acidificada com ácido fosfórico. Desse modo, a identificação dos fármacos foi realizada com base em seus comprimentos de onda característicos, especificamente 254 nm para a zidovudina e 277 nm para a lamivudina (LAVRA et al., 2008). Validação da metodologia: esta etapa foi realizada através da determinação dos seguintes parâmetros: linearidade (reprodutibilidade), precisão, limite de detecção (LD) e limite de quantificação (LQ). Utilizando-se de regressão linear foi calculado o coeficiente de correlação (r) para cada curva, de modo a definir a linearidade do método. Em seguida foi avaliada a precisão dos dados obtidos a partir da determinação do coeficiente de variância (CV), conforme Equação 1 e, logo após, foram definidos os limites de detecção (LD) e de quantificação (LQ) conforme Equações 2 e 3, respectivamente. Vale ressaltar que os limites de detecção e quantificação foram determinados a partir da análise de 10 vezes o menor ponto da curva, para os dois fármacos. CV (%)= s/x ̅ (1) LD= x ̅+ (t_(n-1)∙σ) (2) LQ=x ̅+(10∙σ) (3) A reprodutibilidade dos dados foi avaliada com base na análise de sete replicatas de cada uma das concentrações das curvas analíticas, empregando para isso dois diferentes operadores. A dispersão dos dados foi avaliada de acordo com o teste de Grubb's conforme Equações 4 e 5. G_<= (x ̅-x_<)/σ (4) G_>= (x ̅-x_>)/σ (5)
Resultado e discussão
As duas curvas analíticas foram construídas com base na determinação das
médias das áreas de cada um dos sete pontos de concentração definidos
anteriormente. Em seguida, foram calculados os desvios padrões e analisada a
dispersão dos dados, os valores obtidos estão dispostos na Tabela 1.
Os valores obtidos, foram analisados quanto a dispersão através do teste de
Grubbs, e estão em conformidade para 95% de confiança, uma vez que todos os
resultados obtidos são inferiores a 2,020, valor de referência para sete
medições.
A partir dos dados disponíveis na Tabela 1 pôde-se realizar a construção das
curvas analíticas, assim como determinar os respectivos coeficientes de
correlação (r). As curvas analíticas para a lamivudina e zidovudina
apresentaram valores de r em conformidade com os padrões exigidos pelo órgão
competente (Agência de Vigilância Sanitária - ANVISA), ou seja, maiores que
0,99. Os valores de r, respectivamente (curva menor (de 1 a 10 mg/L) e curva
maior (de 10 a 100 mg/L)), foram: 1) lamivudina (0,9914; 0,9978); 2)
zidovudina (0,9940; 0,9994).
As Equações de 6 a 9 representam, respectivamente, as curvas menor e
maior para a lamivudina e zidovudina. Já a Figura 1 apresenta a forma
gráfica destas curvas.
Y = 42146x + 10262
(6)
Y = 41782x – 68991
(7)
Y = 28572x + 767,42
(8)
Y = 25840x + 12402
(9)
Uma vez verificada a linearidade do método, passou-se a determinação da
precisão, que conforme dados dispostos na Tabela 1, o método pode ser
considerado preciso. Esta observação foi feita a partir dos valores de CV,
que se apresentaram inferiores a 20%. Por fim, foram determinados, para
cada um dos compostos, os valores de LD e LQ, em respectivo: lamivudina
(52448,18 mg/L e 107739,3 mg/L); zidovudina (28885,95 mg/L e 55302,9 mg/L).
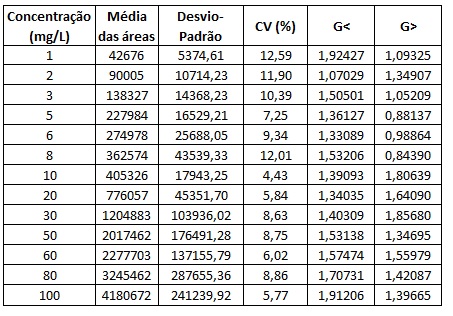
Valores obtidos para as médias das áreas, desvio- padrões, G<, G> e CV(%)
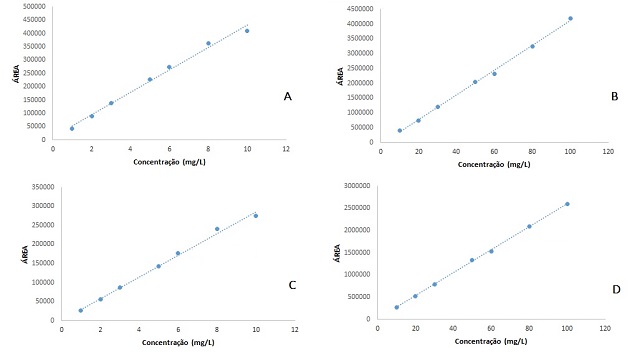
Curvas analíticas para os fármacos lamivudina (A)curva menor, B) curva maior); e zidovudina (C)curva menor, D) curva maior)
Conclusões
O presente trabalho permitiu dispor de uma metodologia via CLAE para detecção e quantificação dos fármacos lamivudina e zidovudina, sendo estes observados nos comprimentos de onda de 254 nm para a zidovudina e 277 nm para a lamivudina. Constatou-se ainda que o método empregado é confiável e preciso, uma vez que foi realizada a validação de metodologia atendendo aos padrões exigidos pela ANVISA, podendo ser empregado na análise desses dois compostos.
Agradecimentos
Ao NUQAAPE/FACEPE; CAPES.
Referências
CORBETT, M. A brief history of AZT. National Museum of American History. 2010.
KAZAKEVICH, Y.; LoBRUTTO, R. HPLC for pharmaceutical scientists. New Jersey, Wiley & Sons, Inc. 2007.
LAVRA, Z. M. M.; NETO, P. J. R.; da SILVA, R. M. F.; de MEDEIROS, F. P. M. Desenvolvimento e validação de método analítico para determinação simultânea de lamivudina, zidovudina e nevirapina em comprimidos dose-fixa combinada por cromatografia líquida de alta eficiêciencia. Química Nova. v. 31, No. 5, 969-974, 2008.
NAPOLEÃO, D. C.; PINHEIRO, R. B.; ZAIDAN, L. E. M. C.; RODRIGUEZ-DIAZ, J. M.; ARAÚJO, A. N.; MONTENEGRO, M. C.; SILVA, V. L. Validation of a chromatographic method for amoxicillin determination in wastewaters after its degradation by advanced oxidation process. Desalination and Water Treatment. V. 55, P. 1-7, 2015.
RIBANI, M.; BOTTOLI, C. B. G.; COLLINS, C. H.; JARDIM, I. C. S. F.; MELO, L.
F. C. Validação em métodos cromatográficos e eletroforéticos. Química Nova, v. 27, n.
5, p. 771-780, 2004.
SCOTT, R. P. W. Principles and practice of chromatography. Chrom-Ed Book Series, Book 1. Library for Science, 2003.
SHABIR, G. A. Validation of high-performance liquid chromatography methods for pharmaceutical analysis. Understanding the differences and similarities between validation requirements of the US Food and Drug Administration, the US Pharmacopedia and the Internation Conference on Harmonization. Journal of Chromatography A, v. 987, n 1-2, p. 57-66, 2003.
United States Department of Health and Human Services. Food and Drug Administration (FDA). Analytical Procedures and Methods Validation for Drugs and Biologics – Guidance for Industry. 2015.
ZAIDAN, L. E. M. C.; NAPOLEÃO, D. C.; GUIMARÃES, G.; BARBOSA, C. M. B. M.; BENACHOUR, M.; SILVA, V. L. Validation Methodology for Identification and 99 Measurement of Phenolic Compounds in oil Refinery Effluent by HPLC. Brazilian Journal of Petroleum and Gas, v. 7, n. 3, p. 95-106, 2013.
































