DESENVOLVIMENTO DE MÉTODO UTILIZANDO AREIA COMO SUPORTE SÓLIDO NA MSPD MODIFICADA PARA EXTRAÇÃO DE AGROTÓXICOS EM COUVE
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Santos, E. (FURG) ; Gonzalez, J. (FURG) ; Furlong, E.B. (FURG) ; Primel, E.G. (FURG)
Resumo
O monitoramento de resíduos de agrotóxicos em alimentos é uma prioridade de programas e políticas para a garantia da segurança alimentar da população, porém devido à complexidade destas matrizes, se torna necessário um procedimento de preparo de amostra para extrair os analitos e remover os interferentes. A otimização das condições experimentais permite a redução do custo, redução na exposição do analista a solventes tóxicos e limpeza do extrato. Com isso, o objetivo deste trabalho foi avaliar o uso da areia como suporte sólido na técnica de dispersão da matriz em fase sólida modificada para extração de multiclasses de agrotóxicos de amostras de couve empregando determinação por cromatografia gasosa acoplada a espectrometria de massas.
Palavras chaves
MSPD; couve; areia
Introdução
A preocupação com a presença de agrotóxicos em amostras de alimentos se dá pelos efeitos adversos para a saúde humana. A análise dos resíduos de agrotóxicos representa um mecanismo para a proteção da saúde humana e para fins comerciais e de controle. Apesar da análise de rastreamento de agrotóxicos ser realizada desde a década de 70, ainda permanece um desafio, pois diferentes classes químicas podem estar presentes em baixas concentrações em matrizes complexas. Portanto, o desenvolvimento de métodos analíticos multirresíduos que gerem resultados robustos e confiáveis com menores limites de detecção são muito importantes para a implementação de medidas de controle e monitoramento de resíduos de agrotóxicos em alimentos (CORREIA et al., 2016). Diferentes métodos para a determinação de agrotóxicos em amostras de alimentos foram propostos em muitos países em todo o mundo há vários anos (ANASTASSIADES et al., 2003). No entanto, amostras como frutas e hortaliças são matrizes complexas e uma ampla multiplicidade de agrotóxicos com uma grande variedade de propriedades físico-químicas podem ser encontrados nestas matrizes, assim, ainda não há um método perfeitamente adequado para a determinação simultânea de multiclasses de agrotóxicos. Diversos materiais como terra diatomácea, sílica, alumina neutra e C18 tem sido estudados quanto a sua aplicação como sorventes na extração de agrotóxicos polares em amostras de plantas (CAPRIOTTI et al., 2015). Alguns destes suportes possuem um custo elevado e apresentam risco a saúde do analista. Na MSPD, a natureza dos sorventes é um parâmetro importante que afeta a eficiência da extração, o dispersante é utilizado como não só um suporte sólido para romper e dispersar a amostra, mas também um material que promove a separação por adsorção. No entanto, devido à falta de seletividade dos dispersantes comuns e fraca capacidade de adsorção dos interferentes o maior desafio da MSPD consiste em extrair analitos de amostras complexas (WANG et al., 2014; PENG et al., 2016). A areia é um suporte sólido abundante, natural, de baixo custo, ambientalmente mais amigável que os tradicionais. Além disso, devido as diferenças na natureza química dos materiais abrasivos, os analitos podem interagir com materiais como C18, no entanto a interação com materiais de areia do mar, que são compostos principalmente de silicatos inertes e óxidos inertes ocorre provavelmente de forma mais fraca (MANHITA et al., 2006). A areia é um suporte sólido com composição mista, variando dependendo da sua origem. Tendo sido utilizada desde 1996 por Viana, Moltó e Font em diversas matrizes vegetais para extração de 9 agrotóxicos. Diversos trabalhos que empregam areia na MSPD utilizam a obtida comercialmente, composta geralmente por sílica, no entanto, poucos trabalhos descrevem o uso de areia coletada na praia, sem composição definida e sem etapa de purificação (TEIXEIRA e COSTA, 2005; TEIXEIRA et al., 2006; MANHITA et al., 2006).
Material e métodos
Para seleção dos suportes sólidos, solventes, uso de sais e equipamentos utilizados para melhor extração dos agrotóxicos, foram realizados ensaios univariados de recuperação em triplicata em 3 injeções cada, sendo avaliados pelo teste de Tukey. Foi utilizada 0,5 g de amostra, fortificado com 50 μL de uma mistura de 27 padrões de agrotóxicos. Foi adicionado 1 g de suporte sólido, a mistura foi macerada por 5 minutos e transferida para tubos de centrífuga contendo 1 g de sulfato de sódio e 20 mg de carvão ativado, sendo realizada a adição de 10 mL de solvente, seguido de agitação por 1 minuto em vortex e 5 minutos de centrifugação a 10179 xg. Foram testados suportes sólidos clássicos na MSPD, assim como materiais alternativos oriundos de fontes renováveis. Os suportes sólidos testados na MSPD foram: sílica, C18, PSA, alumina, quitina, quitosana, celite e areia. Para seleção do solvente foram avaliados acetonitrila, hexano, acetona e acetato de etila. A utilização de sais foi avaliada sem adição de sal, com adição de 1 g de sulfato de sódio e com adição de 1 g de sulfato de magnésio juntamente com o suporte sólido selecionado. A fim de obter um método rápido e flexível foi avaliada na etapa de extração a utilização de vortex, banho ultrassônico e sonda de ultrassom. O vortex foi utilizado por 5 minutos após a adição de solvente, condição estabelecida em trabalhos prévios. O banho ultrassônico, com potência de 170 Watts e 42 kHz de frequência foi utilizado por 10 minutos, conforme Qi et al (2010). A sonda de ultrassom utilizada possui potência de 500 Watts e 20 kHz de frequência ultrassônica foi utilizada conforme Barfi et al. (2013). A partir da escolha das variáveis qualitativas, foi realizado um planejamento experimental completo, visando otimizar a MSPD para amostra de couve, onde foram avaliadas: a massa de suporte sólido (g), volume de solvente (mL), e massa de carvão ativo (mg) na etapa de limpeza do extrato. A quantidade de suporte sólido a ser utilizado depende da natureza da amostra. No entanto, para a maioria dos estudos, as razões amostra: suporte sólido variam na proporção de 1:1 a 1:4 (CAPRIOTTI et al., 2015). Para avaliação da quantidade de suporte sólido, foi mantida a quantidade de 0,5 g de amostra, assim foram mantidas as relações de amostra:suporte sólido de 1:1 (no nível -1), 1:2 (ponto central) e 1:3 (nível +1), conforme Barker (2007) e Capriotti et al. (2015). Os volumes de solvente avaliados foram escolhidos de acordo com a literatura (LOZOWICKA et al.,2016; WIANOWSKA e DAWIDOWICZ, 2016; HERTZOG et al., 2015). A quantidade de carvão ativo utilizado na etapa de limpeza foi determinada de acordo com os níveis da literatura, buscando reduzir os interferentes e os custos.
Resultado e discussão
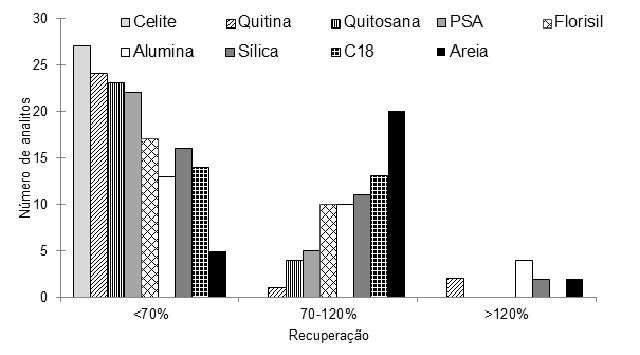
Todos ensaios apresentaram desvio padrão relativo inferior a 20%. Para C18, foi
observado que com a diminuição da polaridade dos analitos, houve a redução nas
recuperações, provavelmente devido a maior afinidade destes analitos com o
suporte sólido, dificultando a eluição (CAO et al., 2015). Com a quitosana foram
obtidas recuperações (entre 1 e 87%). Resultados similares foram obtidos por Peng
et al. (2016), quando utilizado quitosana de baixa viscosidade na MSPD para
extração de fenóis em oliva. Foi possível verificar que a maior quantidade de
multiclasses de analitos pôde ser extraída, com recuperações entre 70 e 120%
utilizando como suporte sólido a areia, este suporte sólido promoveu a
recuperação entre 70 e 120% de 20 analitos, sendo selecionado para as etapas
posteriores. Celite é um material alternativo e de baixo custo, porém não se
apresentou eficiente para os compostos em estudo. Utilizando alumina, os ensaios
apresentaram elevada recuperação (acima de 120%), isto pode ser atribuído a
presença de substância interferentes endógenas (VIANA et al., 1996; MENEZES FILHO
et al., 2006). As propriedades abrasivas da areia parecem proporcionar uma
ruptura mais eficiente do material da planta, quebrando em partículas menores e,
desta forma, expondo, de forma mais eficiente, os componentes da planta aos
eluentes. Visto que a areia quando utilizada como suporte sólido apresentou
recuperações satisfatórias (entre 70-120%,) foi selecionada a areia como suporte
sólido na MSPD nas etapas posteriores.
Para seleção do solvente foram avaliados solventes de diferentes polaridades para
extração, tais como: hexano, acetato de etila, acetona e acetonitrila. O único
parâmetro alterado foi o tipo de solvente, mantendo o volume constante (10 mL).
Foi observada baixa recuperação para a maioria dos analitos quando utilizado
hexano, solvente orgânico mais apolar, assim como o solvente mais polar
(acetonitrila), sendo assim solventes de polaridade média como acetato de etila e
acetona apresentaram recuperações entre 70 e 120% para um maior número de
analitos. Neste trabalho, foi selecionado o acetato de etila que recuperou maior
número de analitos de forma eficiente além da sua toxicidade relativamente
inferior aos demais (PRAT, 2014, PRAT, 2016). Quando utilizado acetato de etila
como solvente na etapa de extração, as recuperações para a maioria dos analitos
foi considerada satisfatória, apresentando valores entre 70 e 120%, com desvios
inferiores a 20%, desta forma o solvente acetato de etila foi escolhido para
extração de agrotóxicos em amostras de couve. Rombaldi et al. (2015) também
avaliou o uso de diferentes solventes, como acetato de etila, acetonitrila e
metanol na extração de agrotóxicos e produtos de cuidado pessoal em mexilhão,
acetato de etila proporcionou recuperações para os agrotóxicos entre 73 e 100%.
Para a seleção de sais, a ausência de sal proporcionou recuperações entre 70 e
120% para a maioria dos analitos. As melhores recuperações quando não foi
utilizado sal, pode ser explicada pela composição da couve, que é uma matriz
complexa, contendo minerais como cálcio, magnésio, manganês, potássio, fósforo,
que podem atuar com a mesma função do sal na MSPD. A adição de sal pode reduzir a
efetividade da etapa de limpeza, assim co-extrativos mais polares tendem a
particionar na fase orgânica. O uso de sulfato de magnésio favoreceu a co-
extração de alguns compostos polares da matriz da amostra, como a clorofila
(REJCZAK e TUZIMSKI, 2015). A adição de sal como sulfato de sódio pode reduzir as
recuperações pelas atrações eletrostáticas entre as moléculas dos analitos e do
sal (FERNANDEZ-ALBA e BARCELÓ, 2005). Para continuidade do trabalho foi
selecionada a condição sem adição de sal na MSPD para extração de agrotóxicos em
couve.
A MSPD auxiliada por banho ultrassônico foi o tratamento mais eficiente para
extração de agrotóxicos em amostras de couve, apresentando recuperações para a
maioria dos analitos entre 70 e 120%. Para agrotóxicos, a energia ultrassônica
tem sido utilizada por promover maior rapidez e eficiência de extração durante
extração sólido-líquido (RAMOS et al., 2008, ALBERO et al., 2017). A eficiência
de cavitação em uma sonda é maior do que um banho de ultrassom porque o sistema
de sonda pode introduzir uma intensidade muito maior para uma zona específica.
Assim alguns analitos mais ensíveis podem ser degradados acarretando em uma
diminuição nas recuperações (RAMOS et al., 2008; SEIDI e YAMINI, 2012).
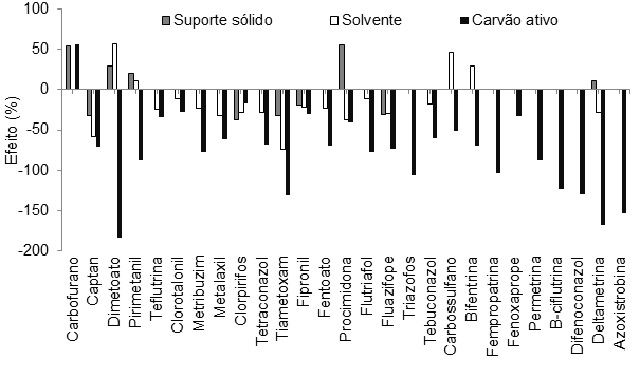
Através da otimização da MSPD foi possível verificar que a variação da quantidade
de suporte sólido teve efeito significativo positivo e negativo para a mesma
quantidade de analitos, desta forma a quantidade de suporte sólido foi mantida no
ponto central, em 1 g, nesta condição a proporção de amostra/suporte sólido foi
de 1:2. Esta proporção está de acordo com a sugerida por KRUVE et al.(2008) e
utilizada em outros trabalhos, para extração de compostos fenólicos halogenados
em frutos do mar e de agrotóxicos em solo (CHEN et al., 2016; LOZOWICKA et al.,
2016). A Figura 2 apresenta os efeitos significativos nas recuperações obtidas
para MSPD através do planejamento experimental. A quantidade de solvente teve
efeito significativo negativo, isto é, quando variadas as quantidades de solvente
de 5 até 15 mL, houve redução na recuperação para a maioria dos analitos, sendo
fixado no nível no nível -1 (5 mL de solvente). A redução na quantidade de
solvente é de grande importância, pois reduz a exposição do analista ao solvente,
bem como a geração de resíduos e possui menor diluição da amostra o que
proporciona menores limites de quantificação. O maior rendimento de extração
observado neste trabalho provavelmente ocorre devido a uma alta afinidade dos
analitos com o eluente escolhido (TEIXEIRA et al., 2006). A quantidade de carvão
ativo teve influência negativa nas recuperações para a maioria dos analitos,
visto que este possui a propriedade de remover também compostos planares (LU et
al., 2012). A quantidade de carvão ativo foi fixado no nível -1, que corresponde
a 20 mg. Neste trabalho, assim como Cao e colaboradores (2015), foi observado que
com o aumento de sorvente a base de carbono, houve aumento na limpeza do extrato.
Entretanto as recuperações para a maioria dos compostos diminuiu, devido a
adsorção dos analitos.
(p>0,05)
Conclusões
Os resultados mostraram que o método proposto é adequado para a determinação de agrotóxicos em amostras de couve, com as características de ser um método rápido, de baixo custo, e menos tóxico. Foi possível utilizar um suporte sólido alternativo natural, como a areia da praia, na MSPD para determinação de multiclasses de agrotóxicos em uma matriz complexa como a couve, sem perdas na eficiência de extração.
Agradecimentos
Agradecimentos: CNPq, CAPES, Fapergs, Finep, EMATER-RG, Prefeitura Municipal de Rio Grande.
Referências
ALBERO, B.; SÁNCHEZ-BRUNETE, C.; MIGUEL, E.; TADEO, J. L. Application of matrix solid-phase dispersion followed by GC–MS/MS to the analysis of emerging contaminants in vegetables. Food Chemistry, v. 217, p. 660-667, 2017.
ANASTASSIADES, M. et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “Dispersive Solid-Phase Extraction” for the determination of pesticide residues in produce. Journal of AOAC International, v. 86, p. 412-43, 2003.
BARFI, B. et al. Simplified miniaturized ultrasound-assisted matrix solid phase dispersion extraction and high performance liquid chromatographic determination of seven flavonoids in citrus fruit juice and human fluid samples: Hesperetin and naringenin as biomarkers. Journal of Chromatography A, v. 1311, p. 30-40, 2013.
BARKER, S. A. Matrix solid phase dispersion (MSPD). Journal of Biochemical and Biophysical Methods, v. 70, p. 151-162, 2007.
CAO, Y.; TANG, H.; CHEN, D.; LI, L. A novel method based on MSPD for simultaneous determination of 16 pesticide residues in tea by LC–MS/MS. Journal of Chromatography B, v. 998, p. 72–79, 2015.
CAPRIOTTI, A.L. et al. Recent advances and developments in matrix solid-phase dispersion. Trends in Analytical Chemistry, v. 71, p. 186–193, 2015.
CHEN, J.; YANG, C.; CHUNG, W.; DING, W. Vortex-homogenized matrix solid-phase dispersion coupled with gas chromatography – electron capture negative-ion mass spectrometry to determine halogenated phenolic compounds in seafood. RSC Advances, v. 6, p. 96510-96517, 2016.
CORREIA, M.; RODRIGUES, M.; PAIGA, P.; DELERUE-MATO, C. Fungicides. In: CABALLERO, B.; FINGLAS, P .M.; TOLDRÁ, F. Encyclopedia of food and health. Reino Unido: Elsevier, v. 3, 2016.
FERNANDEZ-ALBA, A.; BARCELÓ, D. Chromatographic mass spectrometric food analysis for trace determination of pesticide residues, Elsevier, 2005.
HERTZOG, G. et al. Study of vortex-assisted MSPD and LC-MS/MS using alternative solid supports for pharmaceutical extraction from marketed fish. Analytical and Bioanalytical Chemistry, v. 407, p. 4793-4803, 2015.
KRUVE, A.; KUNNAPAS, A., HERODES, K.; LEITO, I. Matrix effects in pesticide multi-residue analysis by liquid chromatography–mass spectrometry. Journal of Chromatography A, v. 1187, p. 58–66, 2008.
LOZOWICKA, B. et al. Multi-residue methods for the determination of over four hundred pesticides in solid and liquid high sucrose content matrices by tandem mass spectrometry coupled with gas and liquid chromatograph. Talanta, v. 151, p. 51-61, 2016.
LU, D. et al. Simultaneous determination of 45 pesticides in fruit and vegetable using an improved QuEChERS method and on-line gel permeation chromatography–gas chromatography/mass spectrometer. Journal of Chromatography B, 895- 896, 17– 24, 2012.
MANHITA, A. C.; TEIXEIRA, D. M.; COSTA, C. T. Application of sample disruption methods in the extraction of anthocyanins from solid or semi-solid vegetable samples. Journal of Chromatography A, v. 1129, p. 14–20, 2006.
MENEZES FILHO, A.; NAVICKIENE, S.; DÓREA, H. S. Development of MSPD method for the determination of pesticide residues in tomato by GC-MS. Journal of the Brazilian Chemical Society, v. 17, n. 5, 874-879, 2006.
PENG, L.et al. Determination of natural phenols in olive fruits by chitosan assisted matrix solid-phase dispersion microextraction and ultrahigh performance liquid chromatography with quadrupole time-of-flight tandem mass spectrometry. Journal of Chromatography B, v. 969, p. 205–212, 2014.
PRAT, D.; WELLS, A.; HAYLER,J.; SNEDDON, H.; ELROY , C. R. M.; ABOU-SHEHADA, S.; DUNN, P. J. CHEM21 Selection Guide of Classical– and Less Classical – Solvents. Green Chemistry, 2013.
PENG, L.; LI, Q.; CHANG, Y.; AN, M.; YANG, R.; TAN, Z.; HAO, J.; CAO, J.; XU, J.; HU, S. Determination of natural phenols in olive fruits by chitosan assisted matrix solid-phase dispersion microextraction and ultrahigh performance liquid chromatography with quadrupole time-of-flight tandem mass spectrometry. Journal of Chromatography A, v. 1456, p. 68-76, 2016.
PRAT, D.; HAYLER, J.; WELLS, A. A survey of solvent selection guides. Green Chemistry, v.16, p. 4546-4551, 2014.
QI, X. Development of a matrix solid-phase dispersion-sonication extraction method for the determination of fungicides residues in ginseng extract. Food Chemistry, v. 121, p. 758–762, 2010.
RAMOS, J.; RIAL-OTERO, R.; RAMOS, L.; CAPELO, J. R. Ultrasonic-assisted matrix solid-phase dispersion as an improved methodology for the determination of pesticides in fruits. Journal of Chromatography A, v. 1212, p. 145-149, 2008.
REJCZAK, T.; TUZIMSKI, T. A review of recent developments and trends in the QuEChERS sample preparation approach. Open Chemistry, v. 13, p. 980-1010, 2015.
ROMBALDI, C.; ARIAS, J. L. O.; HERTZOG, G. I., CALDAS, S.S.; VIEIRA, J. P.; PRIMEL, E. G. New environmentally friendly MSPD solid support based on golden mussel shell: characterization and application for extraction of organic contaminants from mussel tissue. Analytical and Bioanalytical Chemistry, v. 407, p. 4805-4814, 2015.
RUBERT, J.; SOLER, C.; MAÑES, J. Evaluation of matrix solid-phase dispersion (MSPD) extraction for multi-mycotoxin determination in different flours using LC–MS/MS. Talanta, v. 85, p. 206–215, 2011.
SEIDI, S.; YAMINI, Y. Analytical sonochemistry; developments, applications, and hyphenations of ultrasound in sample preparation and analytical techniques. Central European Journal of Chemistry, v. 10, n. 4, p. 938-976, 2012.
TEIXEIRA, D. M. et al Comparison between sample disruption methods and solid–liquid extraction (SLE) to extract phenolic compounds from Ficus carica leaves. Journal of Chromatography A, v. 1103, p. 22-28, 2006.
TEIXEIRA, D. M.; COSTA, C. T. Novel methods to extract flavanones and xanthones from the root bark of Maclura pomifera. Journal of Chromatography A, v. 1062, p. 175–181, 2005.
VIANA, E.; MOLTÓ, J. C.; FONT, G. Optimization of a matrix solid-phase dispersion method for the analysis of pesticide residues in vegetables. Journal of Chromatography A, v. 754, p. 437-444, 1996.
WANG Z. et al. Determination of phenolic acids and flavonoids in raw propolis by silica-supported ionic liquid-based matrix solid phase dispersion extraction high performance liquid chromatography-diode array detection. Journal of Chromatography B, v. 969, p. 205–212, 2014.
WIANOWSKA, D.; DAWIDOWICZ, A. L. Can matrix solid phase dispersion (MSPD) be more simplified? Application of solvent less MSPD sample preparation method for GC–MS and GC–FID analysis of plant essential oil components. Talanta, v. 151, p. 179–182, 2016.
































