Desenvolvimento de metodologia espectroscópica para a determinação de monóxido de carbono.
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Lindino, C.A. (UNIVERSIDADE ESTADUAL DO OESTE DO PARANÁ- UNIOESTE) ; Pauletti, C. (UNIVERSIDADE ESTADUAL DO OESTE DO PARANÁ- UNIOESTE)
Resumo
O monóxido de carbono (CO) pode ser determinado por meio de técnicas analíticas, as quais podem ser dispendiosas. Neste trabalho, utilizou-se um reagente, o complexo aminpentacianoferrato, no desenvolvimento de metodologia espectrofotométrica a partir da troca de ligante NH3 pela carbonila (CO), com a diminuição da coloração na região do visível pelo aumento na concentração do gás. A faixa de concentração linear ocorre entre 0,5 a 2,8 mg de CO, com R2= 0,9939 e repetitividade de 4,6%. Os testes de robustez indicaram forte influencia da concentração do complexo no sinal analítico e pouca influencia de variações de temperatura e tempo de agitação. Com isto, desenvolveu-se um método confiável, de baixo custo e de fácil manipulação para a determinação de monóxido de carbono.
Palavras chaves
poluente; saúde pública; nitroprussiato
Introdução
O monóxido de carbono (CO) causa asfixia. Isto ocorre por causa de sua ligação à hemoglobina, pela qual tem maior afinidade que o oxigênio, fato que impede a proteína de se ligar ao O2, o que provoca hipóxia tecidual (Pina & Furlan, 2007). O CO é resultado da oxidação ou combustão parciais de materiais orgânicos como a madeira, tabaco e derivados de petróleo e, se produzido em excesso, se torna um poluente atmosférico relevante. Para a determinação de monóxido de carbono, a Resolução CONAMA nº 03/1990 estabelece o uso de infravermelho não dispersivo, preconizada pela NBR 13157/94 (Abnt, 1994). Este método possui custo elevado, o que dificulta sua implantação. Já medidas espectroscópicas no visível são de fácil utilização, menor custo e permitem controle à reações seletivas do analito. Kenney et al. (1961) estudaram a formação de compostos coloridos de pentacianoferratos com CO que podem ser preparados a partir de complexos como ferrocianeto, Fe(CN)64- e nitroprussiato, Fe(CN) 5NO2-, que formam o aminpentacianoferrato(Equação 1)(Toma, 1974; Toma, 1979). [Fe(CN)5NO]2-+ 2NH3+ OH- ⇒ [Fe(CN)5NH3]3- + N2 + H2O (I) Em água, o complexo apresenta equilíbrio dissociativo que pode gerar o íon [Fe(CN)5H2O]3-, e por ser uma solução estável e de fácil preparo, complexa com o ligante CO em condições ambiente. A reação ocorre porque o CO é um ligante de campo forte da série espectroquímica. O complexo carbonilado não absorve na região do visível e a diminuição da absorvância do complexo [Fe(CN)5NH3]3- é correlacionada à concentração de CO que reage com ele. A possível obtenção do derivado carbonílico despertou interesse neste estudo com o complexo em reação com monóxido de carbono para a determinação do mesmo.
Material e métodos
O composto Aminpentacianoferrato de Potássio, K3[(CN) 5Fe(NH3)].3H2O foi sintetizado pelo procedimento descrito na literatura (Kenney et al., 1961) a partir de K2[Fe(CN)5(NO)].2H2O 99,5% (Vetec) pulverizado, com solução de amônia 30% v/v (Carlo Erba) contendo acetato de sódio anidro. A solução é mantida em banho termostatizado a 10 ± 1 oC por 10 horas. O sólido amarelo formado é filtrado à vácuo, redissolvido em mínima quantidade de água a 5 °C e reprecipitado com etanol 95% v/v (Vetec) a 5,0 °C. Filtra-se a mistura novamente e, ao primeiro filtrado, adiciona-se etanol 95% v/v refrigerado para precipitar o restante do complexo aminpentacianoferrato(III) de potássio. Coletou-se o sólido formado por filtração, lavado com etanol e mantido sob vácuo em dessecador com sílica gel. Para os testes analíticos, a solução de aminpentacianoferrato na concentração 0,0026 mol L-1, foi utilizada em absorvância até o valor de 1. Em tubos de vidro utilizados em coleta de sangue com capacidade de 4,5 mL colocou-se 4 mL da solução 0,0026 mol L-1 adicionando-se em cada tubo volumes de 0 mL, 0,5 mL, 1 mL, 1,5 mL, 2 mL, 2,5 mL e 3 mL de CO, em duplicata, por meio de seringa hipotérmica, agitando-se o tubo por um minuto. Em cada medida, mediu-se a temperatura ambiente e os dados de pressão atmosférica a partir do Sistema Meteorológico do Paraná (Simepar), utilizados para o cálculo de mol de monóxido de carbono. A leitura de absorvância da solução foi feita em espectrofotômetro Shimadzu UV1800 com varredura na faixa entre 600 a 300 nm em cubeta de quartzo e caminho óptico de 1 cm. Após os estudos preliminares, os parâmetros de mérito analítico (seletividade, robustez, faixa linear, repetitividade, exatidão, precisão, recuperação) foram validados.
Resultado e discussão
A reação de formação do complexo carbonilado que permite a determinação de
monóxido de carbono pela análise espectrofotométrica está exemplificada pela
Equação 2.
[Fe(CN)5H2O]3-(aq)+ CO (g) ⇒ [Fe(CN)
5CO]3-(aq) ( eq. 2)
Ao adicionar o volume de gás monóxido de carbono, seguida de agitação,
ocorre a troca do ligante água na esfera de coordenação pelo ligante
carbonila e a intensidade da coloração da mesma é diminuída.
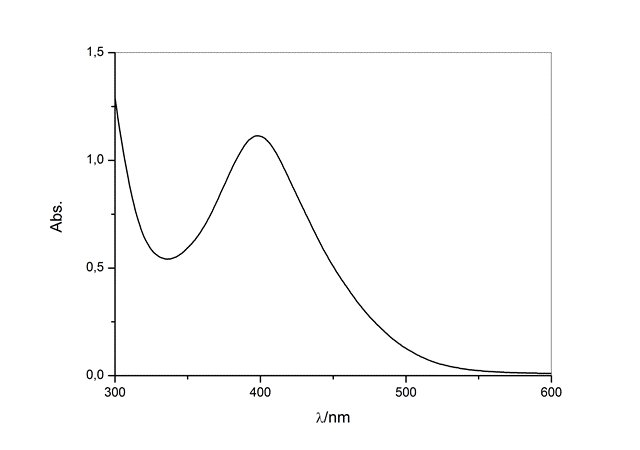
O complexo tem o máximo de absorvancia no comprimento de onda igual a 400 nm
(Figura 1) e com a adição de monóxido de carbono, há o decaimento desta
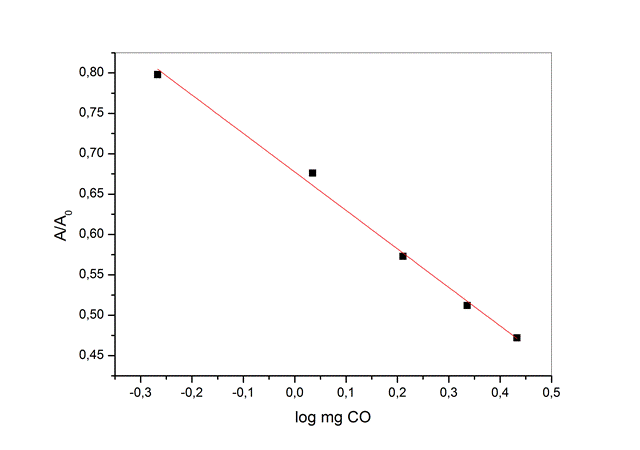
absorvância proporcional à concentração de monóxido de carbono (Figura 2),
sendo linear na faixa entre 0,5 e 2,8 mg, com R2= 0,9939,
repetitividade de 4,6% e estabilidade do complexo de ± 1,0% nos 15 minutos
após a reação. Testes de repetividade em três níveis de concentração (0,5;
1,5 e 2,8 mg de CO) indicaram variação de 3,1% a 4,6%. O teste de robustez
indicou que a concentração do complexo influencia fortemente no sinal
analítico, enquanto que variações na temperatura e no tempo de agitação não
exercem influencia significativa, ao nível de 95% de confiança.
Conclusões
O método proposto apresenta figuras de mérito analítico que permitem sua utilização na determinação de monóxido de carbono com custo baixo e confiança no controle e determinação de monóxido de carbono a fim de minimizar os impactos na saúde humana em ambientes de trabalho ou domésticos.
Agradecimentos
Ao CNPq pelo suporte financeiro.
Referências
Conama - Conselho Nacional de Meio Ambiente (1990). Resolução 03, 28 de junho de 1990. Diario Oficial da União, Brasília, 15.937 a 15.939.
Abnt - Associação Brasileira de Nomas Técnicas. (1994). Determinação da concentração de monoxido de carbono por espectrofotometria de infravermelho não despersivo. NBR 13157/94. Rio de Janeiro.
Kenney, D.J., Flynn, T.P., Gallini, J.B. (1961). Reaction of Ferropentacyanamines. Journal of Inorganic and Nuclear Chemistry 20, 75-81.
Pina, R. Z. & Furlan, M. M. D. P. (2007). Monóxido de carbono: uma nova molécula de sinalização celular. Sinalização por monóxido de carbono. Arquivos do Mudi 11, 20-28.
Toma, H. E. (1979). Cianoferratos: correlação de estrutura, reatividade e intervalência. Tese (Livre Docência em Química Inorgânica) - Instituto de Química, Universidade de São Paulo, São Paulo.
Toma, H. E. (1974). Influências das interações de transferência de elétrons no comportamento dos complexos de pentaaminrutênio (II) e de pentacianoferrato (II) com ligantes insaturados. Tese (Doutorado em Química Inorgânica) - Instituto de Química, Universidade de São Paulo, São Paulo.
































