Avaliação da produção de biomassa e da composição lipídica em um sistema Algae Turf Scrubber
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Rubert, A. (UNISC) ; Martini, F.A. (UNISC) ; Kist, L.T. (UNISC) ; Schneider, R.C.S. (UNISC)
Resumo
Reservatórios de água para abastecimento tem a potencialidade de eutrofizar. Uma das opções de tratamento, ou seja de remoção de nutrientes da água, para controle do processo de eutrofização, é o emprego de Algae Turf Scrubber (ATS®).O Objetivo do trabalho foi avaliar a formação de biomassa em um sistema ATS piloto e a composição lipídica desta biomassa. O total de biomassa obtido para a primeira coleta foi de 275 gramas com teor lipídico de 7,06±1,64%, e os principais ácidos graxos encontrados foram C14:0, C16:0, C18:1, C18:2 e C18:3. Na segunda coleta o total de biomassa encontrado foi de 179 gramas, representando um teor lipídico de 5,43± 0,46%, sendo que foram encontrados os mesmo ácidos graxos da biomassa da primeira coleta, mostrando a formação do biofilme com potencial lipídico.
Palavras chaves
ATS; MICROALGAS; LIPÍDIOS
Introdução
A eutrofização leva ao crescimento excessivo de plantas aquáticas, algas e macrófitas devido ao aumento da disponibilidade de fatores limitantes necessários à fotossíntese tais como, luz e nutrientes (SCHINDLER et al.,2006). A eutrofização degrada os sistemas de água doce, reduzindo a qualidade da água e alterando o ecossistema (DODDS et al.,2008; FIGUEIREDO et al.,2007). Um dos principais problemas relacionados à eutrofização é a proliferação de cianobactérias em detrimento de outras espécies aquáticas. Muitos gêneros de cianobactérias quando submetidas a determinadas condições ambientais podem produzir toxinas que chegam a ser fatais aos animais e aos seres humanos. Em função da eutrofização, muitos reservatórios e lagos no mundo já perderam sua capacidade de abastecimento de populações, de manutenção da vida aquática e de recreação (FIGUEIREDO et al.,2007). Algal Turf Scrubber (ATS) é um sistema alternativo que utiliza o perifíton formado em um biofilme para controlar uma grande variedade de parâmetros de qualidade da água. Os sistemas ATS™ tem a capacidade de reter nutrientes e produzir biomassa, com as algas em maior abundância. As algas, desta forma atuam de forma ecológica e econômica na restauração de corpos d'água altamente eutrofizados (MAYR et al.,2016). Diante disso, este trabalho visa reconhecer a formação do biofilme no sistema ATS™ piloto instalado em um reservatório de água para abastecimento, bem como a composição lipídica da mesma e o teor de proteínas, visando obter dados para verificar a potencialidade de uso da biomassa coletada.
Material e métodos
Em um reservatório de água para abastecimento de Santa Cruz do Sul foi construído uma unidade de ATS™ piloto, confeccionado em acrílico de 3 mm de espessura, apoiado por uma estrutura de ferro (vigas de aço modelo U de 4”, vergalhão de ferro ¼” e cantoneiras de ferro de ¼”). O sistema possui 6 m de comprimento por 1 m de largura. Cada canal possui 30 cm de largura por 6 m de comprimento. O sistema de bombeamento é realizado através de uma bomba d’água submersível modelo BCS-S1 de 1/6cv, mangueira de ½” em pvc. Canos de ½” de cpvc e válvula de esfera ½” para controle da vazão. A vazão para o fornecimento de água superficial do reservatório é em torno de 5 L/min com uma velocidade de 0,1 m/s e onda artificial pulsante de período ajustável entre 60-120 s. Sobre estes canais foram dispostas telas de nylon com fio de polietileno 0,27 mm e trama 1,2 x 1,2 mm. Após a instalação do ATS™, o perifíton que se prolifera nos dos três canais da rampa, formam um biofilme. A coleta é feita a cada 14 dias e a biomassa é filtrada em tecido e seca em estufa com circulação de ar a 50 °C até peso constante. Depois do biofilme seco e triturado em moinho de facas do tipo willey foi realizado a extração da fração lipídica pelo método de Bligh & Dyer. Em seguida foi realizado a derivatização dos triacilgliceróis dos lipídios em ésteres metílicos para verificação da composição de ácido graxo por cromatografia gasosa com detector de massas (CG-EM). A coluna capilar utilizada foi a ZBwax(30mx0,25mmx0,25μm) em condições conforme SOUZA et al. (2017). A analise de proteínas na biomassa foi realizada a partir do resultado de nitrogênio na analise elementar. O equipamento utilizado foi da Perkin Elmer 2400.
Resultado e discussão
Os resultados indicam que a rampa foi construída em condições para a
formação do biofilme. A quantidade de biomassa no biofilme formado
encontrados para a primeira coleta foi de 275 gramas e na segunda coleta o
total de biomassa encontrado foi de 179 gramas.O rendimento de biofilme
aderido na rampa da segunda coleta foi menor do que da primeira coleta.
A composição de ácidos graxos das coletas apresenta-se iguais
mudando somente a concentração encontrada. O teor de ácidos graxos
insaturados foi maior nas duas coletas. O percentual lipídico da primeira
coleta dos três canais apresentou uma média de 7,06±1,64 % enquanto que a
segunda coleta foi de 5,43± 0,46%. No período de frio intenso a formação de
biomassa não foi observada, sendo portanto, um problema a ser resolvido para
uso da rampa para biorremediação de nutrientes presentes na água.
Quanto ao teor de proteínas determinado a partir da analise de nitrogênio em
CHNOS, foi de 22,8±4,2%.
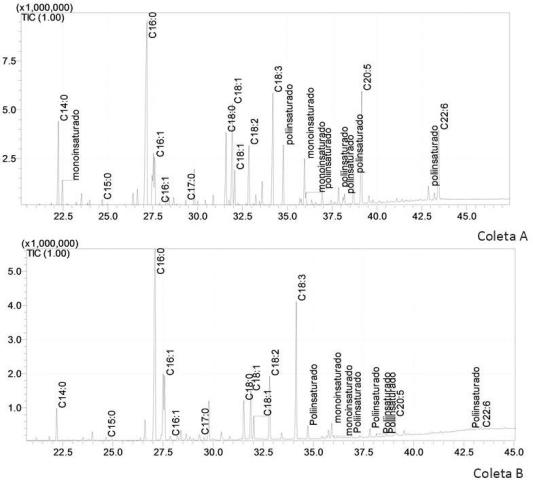
Cromatograma da fração lipídica da primeira coleta (Coleta A) e segunda coleta (Coleta B) de biomassa do sistema ATS.
Conclusões
Conforme os resultados encontrados no sistema ATS foi possível a formação do perifíton, na forma de um biofilme que ao ser coletado representou em torno de 150 a 280 g a cada 14 dias. Esta biomassa apresenta uma composição lipídica >5%, não sendo o principal constituinte da biomassa. O teor de proteínas é de aproximadamente 22 % e ainda é necessário avaliar a composição quanto a carboidratos. Inicialmente esta biomassa apresenta uma característica interessante para uso como ração animal.
Agradecimentos
CNPq (309652/2016-2), PUIC-UNISC, CAPES
Referências
DODDS, W. K. et al. Eutrophication of U.S. freshwaters: analysis of potential economic damages. Environmental Science and Technology, v.43 n.1, p.12-19, 2009.
FIGUEIREDO, M. C. B. et al.Avaliação da vulnerabilidade ambiental de reservatórios à eutrofização. Engenharia Sanitária Ambiental, v.12 n.4 p.399-409, 2007.
MAYER M.; SCHAGER M.; JERNEY J. Biofilm scrubbing for restoration—algae community composition and succession in artificial streams. AIMS Environmental Science, v.3 n.3 p.560-581, 2016.
SCHINDLER, D. W. Recent advances in the understanding and management of eutrophication. Limnology and Oceanography, v.51, n.1 356-363,2006.
SOUZA L.S.et al.. Morphological and ultrastructural characterization of the acidophilic and lipid-producer strain Chlamydomonas acidophila LAFIC-004 (Chlorophyta) under different culture conditions. Protoplasma, v.254 p.1385–1398,2017.
































