ANÁLISE DAS INTERAÇÕES DO ÁCIDO FERÚLICO COM POLÍMEROS HIDROFÍLICOS E COPOLÍMEROS UTILIZADOS EM DISPERSÕES SÓLIDAS POR DSC, TG/DTG e FTIR
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Ilary Costa Duarte, F. (UFRN) ; Cabral Ferreira, J. (UFRN) ; Nascimento dos Santos, J.M. (UFRN) ; Quixabeira Leite, G. (UFRN) ; Ferrari, M. (UFRN) ; Arantes Ostrosky, E. (UFRN) ; Barreto Gomes, A.P. (UFRN) ; Antonini Neves de Lima, (UFRN)
Resumo
O ácido ferúlico (AF) é um constituinte fitoquímico inerente dos polifenóis e encontrado no farelo de arroz e de milho, com destaque para atividade fotoprotetora e antioxidante. O AF e seus compostos relacionados vêm sendo amplamente estudados na área alimentícia, farmacêutica e cosmética. Entretanto, seu uso é limitado pela baixa solubilidade aquosa e instabilidade da molécula. Estes problemas podem ser amenizados pela obtenção de dispersões sólidas. O presente estudo propõe-se avaliar as interações que ocorrem em misturas binárias (p/p) entre o AF e os principais polímeros, candidatos a dispersão sólida com AF, aplicando-se DSC, TG/DTG e FTIR. Constatou-se que há interação predominantemente física entre os polímeros e o AF, sendo adequados para obtenção de dispersões sólidas.
Palavras chaves
Ácido Ferúlico; Polimeros ; Dispersões sólidas
Introdução
Ácido ferúlico (AF) ou ácido 4-hidroxi-3-metoxicinâmico é um antioxidante fenólico encontrado em altas concentrações em plantas, principalmente no farelo de arroz e de milho. Destaca-se por sua atividade fotoprotetora, antioxidante e pela capacidade de minimizar os efeitos dos dímeros de timina que são agentes carcinogênicos. Com isto, o AF e seus compostos relacionados estruturalmente vêm sendo amplamente estudados, com aplicação na área alimentícia, farmacêutica e cosmética (SOHN & OH, 2003; ANSELMI et al., 2006; GRAF, 2010; KIM et al., 2012). Entretanto, a aplicação do AF é limitada pela baixa solubilidade aquosa e instabilidade da molécula, que pode decompor-se em produtos inativos, induzidos pela luz e/ou oxidação (MONTI et al., 2011). Estes problemas podem ser amenizados através da obtenção de dispersões sólidas, que consiste genericamente na dispersão de um componente farmacologicamente ativo em um carreador polimérico, obtendo-se geralmente melhor solubilidade e aumento na taxa de dissolução. Além disto, este método com foco no incremento de solubilidade também é capaz de aumentar a estabilidade físico-química de fármacos (SETHIA; SQUILANTE, 2003; JANSSENS et al., 2008; LIMA et al. 2008). Diante disto, o presente estudo propõe-se avaliar as interações que ocorrem em misturas binárias (p/p) entre o ácido ferúlico e os principais polímeros hidrofílicos, sendo estes PEG 6000, PVP K30 e os copolímeros Kollidon® V64 e Soluplus®, que podem ser candidatos à obtenção de dispersões sólidas. As técnicas utilizadas foram calorimetria exploratória diferencial (DSC), termogravimetria (TG) e espectroscopia por transformada de Fourier (FTIR).
Material e métodos
Para a realização das misturas físicas (1:1) com ácido ferúlico (Henrifarma®) selecionaram-se os polímeros polietilenoglicol 6000 (PEG 6000), polivinilpirrolidona K-30 (PVP K-30), hidroxipropilmetilcelulose (HPMC), Polivinil caprolactama-acetato de polivinilo-polietilenoglicol (Soluplus®), Copolímero de vinilpirrolidona-acetato de vinilo (Kollidon® VA64), produzidos pela Sigma-Aldrich®. As misturas entre o AF e os polímeros foram realizadas em razão peso/peso. Cada componente foram separadamente pulverizado e posteriormente misturados em gral de porcelana com auxílio de pistilo, sem trituração, até a mistura homogênea ser obtida. As mesmas foram mantidas em dessecador, até a realização dos experimentos. ANÁLISE TÉRMICA A Calorimetria Exploratória Diferencial (DSC) foi realizada no equipamento Shimadzu® modelo DSC-50, pesando-se aproximadamente 2,0 mg da amostra em cadinho de alumínio hermeticamente fechado, sob atmosfera de nitrogênio, fluxo do gás de purga de 100 mL.min-1, razão de aquecimento de 10° C.min-1 com temperatura final de 300°C. As análises Termogravimétricas (TG) dos componentes e das misturas binárias realizadas em termobalança Shimadzu® modelo DTG-60H, amostras de aproximadamente 5,0 mg foram pesadas em cadinho de alumina, sob atmosfera de nitrogênio, fluxo do gás de purga de 50 mL.min-1, razão de aquecimento de 10° C.min-1, com temperatura final de 900°C. A análise das curvas obtidas foi realizada utilizando software TA Analysis. ESPECTROSCOPIA NO INFRAVERMELHO POR TRANSFORMADA DE FOURIER (FTIR) Os componentes isolados e as misturas obtidas foram caracterizados por FTIR, sendo submetidos à espectroscopia no infravermelho utilizando espectrômetro Shimadzu, modelo IR Prestige-21. Os espectros foram obtidos com resolução espectral de 4 cm-1 e 20 varreduras na região de 400 a 4000 cm-1.
Resultado e discussão
CARACTERIZAÇÃO TÉRMICA DAS MATÉRIAS-PRIMAS
Através da curva DSC do AF (Fig. 1), na razão de 10 °C.min-1, visualiza-
se a presença de dois picos endotérmicos. O primeiro pico é
característico da fusão do AF, com Tonset de 171,59 °C (ΔH = 131,42 J.g-
1, Tpeak = 173,4 °C) corroborando com a Farmacopeia Japonesa que relata
faixa de fusão entre 173 e 176°C. O segundo evento endotérmico apresenta
Tonset de 186,29 ºC (ΔH = 221,00 J.g-1, Tpeak = 224,78 °C) e é atribuída
a decomposição do AF. A análise da curva termogravimétrica e derivada,
revelam a degradação do AF a temperaturas entre 176,90 – 266,31 °C (Δm =
88,33%), resultados semelhantes foram obtidos por Bezerra et al. (2016).
Observa-se no PEG 6000 uma curva DSC (Fig. 1) com um único evento
endotérmico caracterizado por Tonset = 60,10 °C (ΔH = 181,57 J.g-1 e
Tpeak = 64,15 °C) com comportamento semelhante ao descrito por Almeida
et al. (2011) , na curva TG há um evento de perda de massa (Δm = 96,00
%), com ocorrência entre 212,7 – 285,2 °C.
O PVP K30 apresenta curva DSC (Fig.1) com Tonset = 45,94 °C (ΔH = 351,23
J.g-1; Tpeak = 80,21 °C) que ocorre simultaneamente a uma perda de massa
associada a transição vítrea do material. As curvas TG/DTG apresentam
duas etapas distintas de perda de massa, a primeira etapa ocorre entre
42,8 - 89,34°C (Δm = 7,97 %) correspondente a desidratação devido seu
caráter higroscópico (SILVA et al., 2016). Já a segunda etapa ocorre nas
temperaturas entre 409,3 – 456,9 °C (Δm = 81,86%) relacionada à
degradação da substância e formação de resíduo carbonáceo (DE PAULA;
MANO, 2012)
Com relação ao Kollidon®V64 em sua curva DSC (Fig.1) observa-se um
evento endotérmico Tonset = 50,19 °C (ΔH = 51,03 J.g-1; Tpeak = 50,80
ºC) acompanhado de evento na curva TG em 37,7-67,3°C (Δm = 8,07 %)
caracterizando a perda de água livre como descrito por (CAO et al.,
2015), ainda na curva TG se visualizam mais três etapas de perda de
massa (Δm = 29,35% 50,98%, 3,5%) entre 310,7 – 346,3°C; 417,9 – 460,5°C
e 750,2 – 791,0 °C, respectivamente. De forma que, a quarta perda de
massa pode estar atrelada à decomposição e volatilização dos resíduos.
Soluplus® apresenta curva DSC (Fig.1) caracterizado por um evento
endotérmico com Tonset = 52,70 °C (ΔH = 141, 14 J.g-1; Tpeak = 73,55
ºC), esta endoterma representa a transição do polímero do estado vítreo
para elastomérico e envolve uma entalpia de relaxamento (DJURIS et al.,
2013). As curvas TG/DTG apresentam três etapas de perda de massa,
inicialmente ocorre entre 46,90 – 90,28 °C (Δm = 2,22%), em seguida há
um segundo evento dentre as temperaturas de 307,0 – 339,9 °C (Δm =
23,21%) e o terceiro evento caracteriza-se entre 403,8 – 455,0 °C (Δm =
64,56%).
CARACTERIZAÇÃO TÉRMICA DAS MISTURAS FÍSICAS
Foi possível observar nas curvas DSC (Fig 2a) a supressão do evento
endotérmico característico da fusão do AF. Esta característica presente
em todas as misturas possibilita inferir que houve uma diminuição na
cristalinidade do fármaco presente nessas amostras, por alguma interação
entre os componentes, demonstrando que estes polímeros e copolímeros são
potenciais formadores de dispersões sólidas com o AF (BAIRD; TAYLOR,
2012). Por meio da técnica termogravimétrica, avaliou-se o comportamento
das curvas e as variações de massa das misturas binárias ilustradas na
Fig 2b.
Nas misturas AF:PVP, AF:KOL e AF:SOL tem-se na primeira etapa da perda
de massa a temperaturas que variaram de 39 a 85 °C correspondente a
evaporação da água contida no material. Na segunda etapa de decomposição
destas misturas observa-se na curva TG comportamento semelhante ao AF
analisado isoladamente, embora haja um deslocamento dos eventos de
decomposição do AF para temperaturas menores que variam de 160 a 250 °C.
Estando o AF:KOL (174,1 – 239,0 °C) mais próximo da faixa de
decomposição do AF isolado que se processa em 176,90 – 266,31 °C. Já a
mistura AF:PEG em sua curva termogravimétrica comportou-se de modo a não
exibir a etapa da perda de água, de maneira que na primeira etapa é
possível observar o evento de degradação do AF, ocorrendo numa faixa de
temperatura menor que nas demais misturas (154,8 – 221,8 °C).
Embora o evento de degradação do AF tenha ocorrido em intervalos menores
de temperatura para todas as misturas, pode-se evidenciar a diminuição
significativa no percentual de fármaco degradado como descrito na tabela
1, onde AF:PVPK30 apresentou menor perda de massa do AF (Δm = 36,47 %).
Diante destas considerações de alterações nas análises de DSC e TG/DTG
há grandes indícios de que há interação entre o AF e os polímeros,
entretanto para definir a natureza destas interações (físicas ou
químicas) faz-se necessário o uso de técnicas acessórias, dentre as
quais se selecionou o FTIR.
ESPECTROSCOPIA NO INFRAVERMELHO COM TRANSFORMADA DE FOURIER (FTIR)
A Fig 3 apresenta os espectros experimentais obtidos em
espectrofotômetro FT-IR e os espectros teóricos que provém da soma dos
espectros dos componentes isolados, configurando o que seria o espectro
ideal para uma mistura sem interações a nível químico. Esta estratégia
para avaliação dos espectros é conhecida por correlação de Pearson.
Observando-se a comparação dos espectros teóricos e experimentais para
as misturas com PEG 6000 e Soluplus®, constata-se correlação de Pearson
ao longo de todo o espectro com um R > 0,9 indicando uma alta correlação
e, portanto, apresentando baixa interação química. Com isto, sugere-se a
ocorrência de interação física entre o AF e estes polímeros.
A correlação de Pearson entre os espectros teóricos e experimentais das
misturas com PVP K30 e Kollidon® V64 revelam uma alteração no espectro,
com valor na correlação próximo a 0,8. Esta alteração se dá na região
correspondente a 2.500 cm-1 corresponde à ligação de hidrogênio forte
representado por uma banda larga de intensidade fraca. Sabendo-se que o
PVP K30 e Kollidon® V64 são derivados do 1-etenil-2-pirrolidona
homopolímero apresentam capacidade de formar ligações de hidrogênio com
outras moléculas por conter grupos de elétrons doadores como nitrogênio
e oxigênio (VALERO; PÉREZ-REVUELTA; RODRÍGUEZ, 2003). Com isto, há maior
interação química entre estes polímeros e o AF quando comparado ao PEG
6000 e Soluplus®. Entretanto, na maior parte do espectro a correlação
revela um R próximo a 0,9 levando-nos a observar que prevalece uma
interação física nas misturas AF:PVPK30 e AF:KOL.
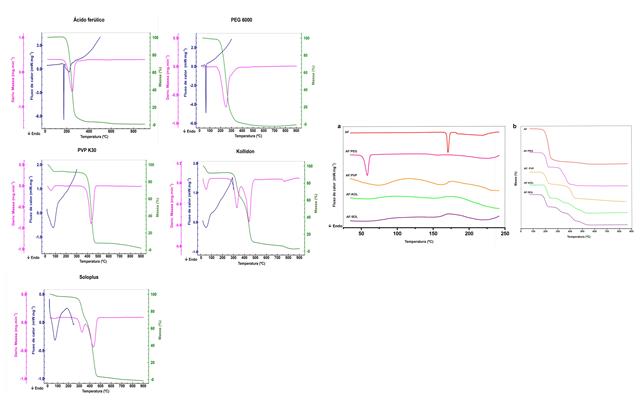
Fig1.Caracterização térmica das matérias- primas na razão de 10°C.min-1 Fig2.a)Sobreposição curvas DSC misturas e b)Sobreposição curvas TG misturas.
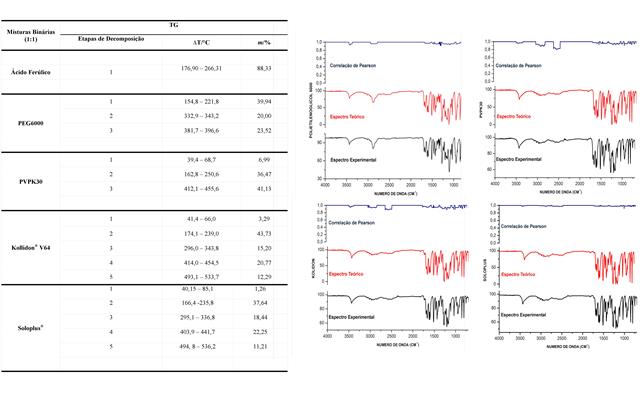
Tabela1.Dados termogravimétricos das misturas binárias 1:1 (p/p) na razão de 10 °C.min-1 Fig3.Correlação de Pearson do AF + Polímeros.
Conclusões
Os métodos selecionados foram satisfatórios na avaliação das misturas. Os polímeros possuem interação majoritariamente física com o ativo, sendo adequados para obtenção de dispersões sólidas com AF.
Agradecimentos
Referências
ALMEIDA, H.M.; CABRAL, H. M.M. Physicochemical characterization of finasteride: PEG 6000 and finasteride: Kollidon K25 solid dispersions, and finasteride: β-cyclodextrin inclusion complexes. Journal of Inclusion Phenomena and Macrocyclic Chemistry , n° 3, p. 397–406 , 2011.
ANSELMI, C.; CENTINI, M.; RICCI, M.; BUONOCORE, A.; GRANATA, P.; TSUNO, T.; FACINO, R.M. Analytical characterization of a ferulic acid/γ-cyclodextrin inclusion complex. Journal of Pharmaceutical and Biomedical Analysis, n° 4, p. 875–881, 2006.
BAIRD, J.A.; TAYLOR, L.S. Evaluation of amorphous solid dispersion properties using thermal analysis techniques. Advanced Drug Delivery Reviews, n° 5, p. 396–421 , 2012.
BEZERRA, G.S.N.; OSTROSKY, E.A.;BARBOSA, E.G.; MOURA, M.F.V.; FERRARI, M.; ARAGÃO, C.F.S.; GOMES, A.P.B.Compatibility study between ferulic acid and excipients used in cosmetic formulations by TG/DTG, DSC and FTIR. Journal Of Thermal Analysis And Calorimetry, p.1-9, 2016.
CAO, Y.J.; ZHANG ,Y.M.; QI, J.P.; LIU, R.; ZHANG, H; HE ,L.C. Ferulic acid inhibits induced oxidative stress and inflammation in rat vascular smooth muscle cells via inhibition of the NADPH oxidase and NF-κB pathway. International Immunopharmacology, n° 2, p. 1018–1025, 2015.
DA SILVA MOURÃO, L.C.; BATISTA, D.R.M.R.; HONORATO, S.B.; AYALA, A.P.; MORAIS, W.A.; BARBOSA, E.G.; RAFFIN, F.N.; LIMA E MOURA, T.F.A.. Effect of hydroxypropyl methylcellulose on beta cyclodextrin complexation of praziquantel in solution and in solid state. Journal of Inclusion Phenomena and Macrocyclic Chemistry , n° 1–2, p. 151–160 , 2016.
DE PAULA, E.L.; MANO, V. Preparação, caracterização e estudos de biodegradação de blendas a base de pdlla e PVP. Quimica Nova, n° 6, p. 1084–1089 , 2012.
DJURIS, J.; NIKOLAKAKIS, I.; IBRIC, S.; DJURIC, Z.; KACHRIMANIS, K. Preparation of carbamazepine-Soluplus solid dispersions by hot-melt extrusion, and prediction of drug-polymer miscibility by thermodynamic model fitting. European Journal of Pharmaceutics and Biopharmaceutics, n. 1, p. 228–237 , 2013.
GRAF, J. Antioxidants and skin care: the essentials. Plastic and reconstructive surgery, n. 1, p. 378–383, 2010.
JANSSENS, S.; DENIVELLE, S.; ROMBAUT, P.; MOOTER, P.G. Influence of polyethylene glycol chain length on compatibility and release characteristics of ternary solid dispersions of itraconazole in polyethylene glycol/ 24 hydroxypropylmethylcellulose 2910 E5 blends. Eur J Pharm Sci., n°35, p. 203-2010, 2008.
KIM, E.O.; MIN, K.J.; KWON, T.K.; UM, B.H.; MOREAU, R.A.; CHOI, S.W. Anti–inflammatory activity of hydroxycinnamic acid derivatives isolated from corn bran in lipopolysaccharide–stimulated Raw 264.7 macrophages. Food and Chemical Toxicology, n°5, p. 1309–1316, 2012.
LIMA, A.N.; SOBRINHO, J.L.S.; CORRÊA JUNIOR, R.A.C.; ROLIM NETO, P. J. Alternative Technologies to Improve Solubility of Poorly Water Soluble Drugs. Lat Am J Pharm., n°5, p. 789-797, 2008.
MONTI, D. Permeation and Distribution of Ferulic Acid and Its α-Cyclodextrin Complex from Different Formulations in Hairless Rat Skin. AAPS PharmaSciTech, n° 2, p.514-520, 2011.
SETHIA, S.S.E. Solid dispersion: revival with greater possibilities and applications in oral drug delivery. Crit Rev Ther Drug Carrier Syst., n° 2, p. 215-247, 2003.
SILVA, P.C.D.; PORTELA, A.S.; LIMA, R.S.C.; SANTANA, C.P.; MEDEIROS, A.C.D; SIMÕES, M.O.S. Compatibility study between lipoic acid with polymers used in controlled drug release systems. Journal of Thermal Analysis and Calorimetry , n. 2, p. 965–971 , 2016.
SOHN, Y. T.; OH, J. H. Characterization of physicochemical properties of ferulic acid. Archives of pharmacal research, v. 26, n. 12, p. 1002–1008, 2003.
VALERO, M.; PÉREZ-REVUELTA, B.I.; RODRÍGUEZ, L.J. Effect of PVP K-25 on the formation of the naproxen:β-ciclodextrin complex. International Journal of Pharmaceutics, n° 1–2, p. 97–110, 2003.
































