Cálculo espectroscópico de ressonância magnética nuclear de 1H de α-D- glicopiranose
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Huiza, J.F.P. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Hinojosa, A.R.C. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Rocha, P.C. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Santos, S.A. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Nery, F.A. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Nascimento, L.P. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Santos, B.M. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA) ; Serafim, E.J. (UNIVERSIDADE ESTADUAL DO SUDOESTE DA BAHIA)
Resumo
A α-D-glicopiranose é a forma predominante da D-glicose, que é um carboidrato energético de importância pela geração de energia dentro das células, que ajudam aos tecidos para cumprir certas funções fisiológicas como a produção de metabólitos secundários como flavonoides, que também tem glicosídeos associados ao sistema fenil-benzopirano. No trabalho modelamos a molécula α-D-glicopiranose e obtemos cálculos de espectro da ressonância magnética nuclear de 1H que tem spin impar, e entra em ressonância com o campo magnético aplicado apresentando picos posicionados nas regiôes dos grupos funcionais ao longo do eixo de deslocamento químico.
Palavras chaves
Glicose; Deslocamento químico; Carboidrato
Introdução
Os carboidratos são moléculas presentes na natureza na diversidade de plantas e animais, representado na fórmula química [C(H2O)]n conhecido também como hidratos de carbono, que desempenham uma ampla variedade de funções como fonte de energia, reserva de energia, estrutural e matéria prima para a biossíntese de outras biomoléculas (POLACOW, 2007). A α-D-glicopiranose cuja fórmula é C6H12O6 é o principal carboidrato presente na estrutura química dos seres vivos, se encontra associada a outros glicosídeos ou polímeros. Além de prover energia constitui a estrutura das plantas na forma de celulosa, e o produto químico industrial provem da sacarosa. Sua inúmera participação nos compostos orgânicos dificulta sua identificação porque tem diferentes configurações conformacionais que complica sua análise, precisamos de técnicas experimentais como ressonância magnética nuclear (RMN) para elucidar sua estrutura, geralmente requer sua determinação analítica pelo RMN 2D, que permita verificar uma apropriada resolução utilizando as constantes de acoplamento (TOUKACH, 2013). Por se tratar de uma molécula de interesse biológico propomos estudar a modelagem com fundamento físico e químico partindo de modelos quânticos que permita obter previsões teóricas dos espectros de RMN e esclareça seu estudo enquanto sua estrutura, para isso usamos GAUSSIAN 09, e outros pacotes de visualização gráfica como AVOGADRO.
Material e métodos
A molécula selecionada para nosso estudo e análise trata da α-D-glicopiranose presente nas plantas e seres vivos que favorece às funções bioquímicas. Desenhamos a molécula C6H12O6 de estrutura cíclica usando o software AVOGADRO, que fornece a geometria molecular básica inicial com uma otimização preliminar simples, gerando as coordenadas da molécula num arquivo de extensão .com, arquivo de entrada para GAUSSIAN 09. Essa geometria molecular preliminar foi otimizada aplicando DFT com o funcional híbrido B3LYP usando o conjunto de base 6-31G(d) e considerando como solvente metanol do modelo de solvatação SCRF. Foram realizados cálculos de NMR=SpinSpin, que é a ressonância magnética nuclear com constantes de acoplamento spin-spin entre os hidrogênios da vizinhança.Os deslocamentos químicos dos hidrogênios da molécula em estudo foram corrigidos com o valor de 32,17 ppm da molécula de referência tetrametil silano Si(CH3)4. Visualizamos o espectro com o pacote AVOGADRO que mostra os picos de absorção no eixo do deslocamento químico. Se procede a comparação dos cálculos dos deslocamentos químicos com os dados obtidos pela Spectral Database for Organic Compounds (SDBS).
Resultado e discussão
Os cálculos realizados de RMN de 1H para a molécula α-D-glicopiranose no solvente metanol mostram picos como descrito na figura 1, nela observamos os deslocamentos químicos em 3,29 ppm (1H, dd, J = 7,1 e 3,9 Hz); 3,48 ppm (1H, dt, J = 8,1 e 1,6 Hz); 3,58 ppm (1H, dd, J = 7,8 e 7,1 Hz); 3,66 ppm (1H, dd, J = 8,1 e 7,8 Hz); 3,86 ppm (2H, d, J = 1,6 Hz) e 5,16 ppm (1H, d, J = 3,5 Hz). Os hidrogênios das hidroxilas tiveram deslocamentos químicos em 0,30; 0,95; 1,35; 2,00 e 2,10 ppm em forma de singleto cada, nelas foram usadas as seguintes abreviações: dt = duplo tripleto, d = dupleto e dd = duplo dupleto. Na figura 2 visualizamos dados experimentais de RMN de 1H para a mesma molécula fornecido pela SDBS no solvente de dimetilsulfóxido, a qual apresenta deslocamentos químicos em 3,10 ppm (1H, dd); 3,57 ppm (1H, dt); 3,42 ppm (1H, dd); 3,04 ppm (1H, dd); 3,57 ppm (2H, d) e 6,20 ppm (1H, d). Os hidrogênios das hidroxilas tiveram deslocamentos químicos em 4,77; 4,37; 4,84; 4,91 e 4,64 ppm.
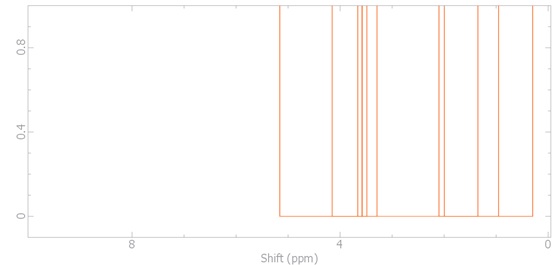
Espectro de ressonância magnética nuclear de 1H de alfa-D-glicopiranose
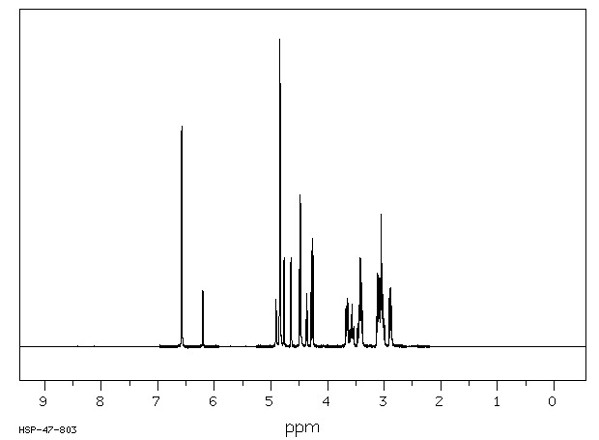
Espectro de RMN de 1H da molécula α-D-glicopiranose fornecido pela SDBS.
Conclusões
Os resultados da molécula modelada, estudada e analisada para os espectros de absorção de RMN de 1H mostraram aproximação e coerência com dados experimentais publicados no Spectral Database for Organic Compounds (SDBS). Entretanto, os hidrogênios das hidroxilas diferem nos valores de deslocamento químico provávelmente devido ao solvente utilizado, porque o solvente gera ligações de hidrogênio.
Agradecimentos
Agradecimentos a Universidade do Sudoeste da Bahia (UESB), e a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
Referências
FRISCH, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani, G.; Barone, V.; Mennucci, B.; Petersson, G. A.; Nakatsuji, H.; Caricato, M.; Li, X.; Hratchian, H. P.; Izmaylov, A. F.; Bloino, J.; Zheng, G.; Sonnenberg, J. L.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Montgomery, Jr., J. A.; Peralta, J. E.; Ogliaro, F.; Bearpark, M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Rega, N.; Millam, J. M.; Klene, M.; Knox, J. E.; Cross, J. B.; Bakken, V.; Adamo, C.; Jaramillo, J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Zakrzewski, V. G.; Voth, G. A.; Salvador, P.; Dannenberg, J. J.; Dapprich, S.; Daniels, A. D.; Farkas, Ö.; Foresman, J. B.; Ortiz, J. V.; Cioslowski, J.; Fox, D. J.; Gaussian 09 Revision A.02, Gaussian Inc. Wallingford CT, 2009.
MEDEIROS, F. C. M. Caracterização química e atividade biológica de óleos essenciais de plantas do Cerrado contra fungos xilófagos. Dissertação de mestrado. Universidade de Brasília, 2014.
ORTOLAN, A. O. Apostila de práticas de química computacional, Trabalho de conclusão de curso, Pato Branco, 2014.
OWOLABI, M. S. Ogundajo A.; Lajide L.; Oladimeji M. O.; Setzer W. N.; Palazzo M. C. Chemical Composition and Antibacterial Activity of the Essential Oil of Lippia multiflora Moldenke from Nigeria, Academy of Chemistry of Globe Publications, vol 3:4, p. 170 – 177, 2009.
POLACOW, V. O. Dietas hiperglicídicas: efeitos da substituição isoenergética de gordura por carboidratos sobre o metabolismo de lipídios, adiposidade corporal e sua associação com atividade física e com o risco de doença cardiovascular, Arq Bras Endocrinol Metab vol.51 no.3 São Paulo Apr. 2007
SILVA, R. C. et al. Carcinogenicidade do carbendazim e sus metabólitos. Química Nova. Brazil, 2014.
SOLANA, R. R. Estudio del proceso de elaboración de bebidas con aguardiente de orujo: Desde las matérias primas empleadas hasta el producto final, Tese do doutorado, Universidad de Vigo, Espanha, 2014.
SDBSWeb : http://sdbs.db.aist.go.jp (National Institute of Advanced Industrial Science and Technology, 08 de junho de 2017).
TOUKACH, F. V. Simulation of NMR observables of carbohydrates. Chemical Society Reviews, 2013.
































