AVALIAÇÃO DA QUALIDADE DE FÁRMACOS ANTIBACTERIANOS FLUOROQUINOLÔNICOS COMERCIALIZADOS EM FARMÁCIAS DE SANTA INÊS/MA
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Aquino, A.F.C. (IFMA-CAMPUS ZÉ DOCA) ; Araújo, K.C.M. (IFMA-CAMPUS ZÉ DOCA) ; Neves, M.A. (UFMA-CAMPUS BACANGA) ; Figueredo, J.L. (IFMA-CAMPUS ZÉ DOCA) ; Brito, N.M. (IFMA-CAMPUS MONTE CASTELO)
Resumo
Atualmente, muito se discute a respeito da qualidade de medicamentos comercializados em diversas partes do mundo, diante disso desenvolveu-se uma metodologia analítica para a determinação quantitativa de ciprofloxacino – CIPRO em soluções oftálmicas comercializadas em farmácias da Cidade de Santa Inês – Maranhão. A metodologia utilizada (CLAE-FL) demonstrou linearidade, pois apresentou o coeficiente de correlação (r2) igual a 0,9985, preciso,seletivo e sensível para quantificação das amostras de antibacteriano fluoroquinolônico (CIPRO) nos fármacos testados. Os teores encontrados para três das quatro amostras (A1, A2, A3)testadas foram satisfatórios, somente o laboratório A3 (79,08%) apresentou teor de CIPRO menor do que o aceitável na solução oftálmica.
Palavras chaves
Qualidade; Ciprofloxacino; Cromatografia
Introdução
Atualmente, muito se discute a respeito da qualidade de medicamentos comercializados em diversas partes do mundo. A adulteração e falsificação de medicamentos antibacterianos têm crescido significativamente com o aumento do consumo e da rentabilidade na área. Uma das maneiras de combater esse problema é detectando os produtos que não atendem as especificações de qualidade. O Controle de Qualidade é a parte da Garantia de Qualidade encarregado de realizar amostragens, especificações, ensaios, procedimentos de organização, documentações e procedimentos de liberação que assegurem que os ensaios necessários e relevantes sejam executados e que os materiais não sejam liberados para uso nem os produtos liberados para venda ou fornecimento antes que a sua qualidade seja julgada satisfatória (BRASIL, 2003b). Pelo levantamento bibliográfico, constatou-se a falta de métodos simples, econômicos e eficazes para a determinação quantitativa de ciprofloxacino em solução oftálmica. Devido aos frequentes problemas de desvios da qualidade e o aumento da utilização de antibióticos no país, torna-se importante avaliar a qualidade dos antibióticos a fim de verificar se estes se encontram dentro dos padrões estabelecidas pelos compêndios oficiais. Para tanto, o presente estudo teve por objetivo o desenvolvimento de uma metodologia analítica para a determinação quantitativa de ciprofloxacino – CIPRO em solução oftálmica comercializados em farmácias da Cidade de Santa Inês – Maranhão.
Material e métodos
O trabalho foi realizado no laboratório do Grupo de Estudos Ambientais do Instituto Federal do Maranhão utilizando um cromatógrafo líquido da marca Shimadzu (modelo DGU 20A5) com duas bombas de alta pressão acopladas a um detector de FL modelo RF-10AXL também da Shimadzu®, e injetor com capacidade de 20 µL e uma coluna Kinetex C18 (50mm x 4,6mm; 2,6 µm) da marca Phenomenex®. Para o controle do equipamento e obtenção dos dados, fez-se uso de um microcomputador e do programa LCsolution®. A partir do padrão analítico de cloreto de ciprofloxacino monohidratado (pureza de 98,0%), marca Fluka®, foi preparada uma solução estoque de 350 mg.L-1 em acetonitrila de grau cromatográfico e depois armazenada em frasco âmbar a 2°C, para posterior diluição e construção da curva analítica. As amostras reais de soluções oftalmológicas monofásicas de Cloridrato de ciprofloxacino e dexametasona (dois éticos, um genérico e um similar) foram adquiridas em farmácias de Santa Inês – MA. Os materiais utilizados foram lavados em solução de Extran® neutro 5% e depois enxaguados com água tipo ultra-pura (18MOms). Os demais reagentes empregados foram de grau padrão analítico e todos da ISOFAR, são eles: ácido orto-fosfórico (85,0%) e fosfato de sódio monobásico (98,0–102,0%). A análise cromatográfica ocorreu em condições isocráticas, com proporções da fase orgânica (ACN ou MeOH) variando entre 15 a 30%, sendo que o melhor perfil de simetria dos picos se apresentou no fluxo de análise de 1 mL.min-1, comprimento de onda de 280nm e a temperatura ambiente.
Resultado e discussão
A especificidade do método foi demonstrada por meio da presença do pico da SQR CIPRO no tempo de retenção ± 0,8 minutos, realizando-se injeções em três concentrações distintas e um branco obtido através da mesma matriz isenta apenas da SQR em questão (solução placebo). A curva analítica para o fluoroquinolônico mostrou-se linear apresentando coeficiente de correlação (r2 = 0,9985) satisfatório, (figura 1A), estando assim em acordo com o que é relatado na literatura (ANVISA, 2016). Determinou-se a precisão sob as condições de repetibilidade (três determinações com três injeções cada) para todas as concentrações da curva de calibração. O método foi o método mostrou-se exato e preciso (coeficiente de variação - CV), com DPR menor que 5% para os três níveis de concentração testados (figura 1B), evidenciando a consistência do método. Os teores encontrados para o lote do laboratório A1 (92,99%), laboratório A2 (99,84%) e laboratório A4 (107,26%) encontraram-se de acordo com as especificações preconizadas pela Farmacopeia Americana (USP 30, 2007), que determina um teor de ciprofloxacino em comprimidos entre 90% e 110% da quantidade declarada do rótulo. Somente o laboratório A3 (79,08%) apresentou teor de CIPRO menor do que o aceitável na solução oftálmica, como mostrado na figura 1C.
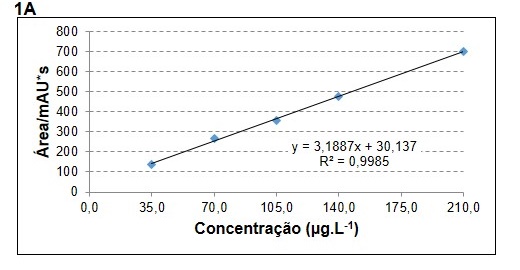
Curva de calibração do composto CIPRO no intervalo de concentração 35 – 210 µg.L-1
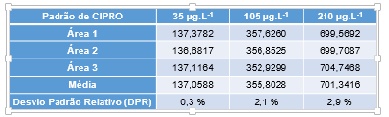
Valores de áreas utilizados no cálculo da precisão
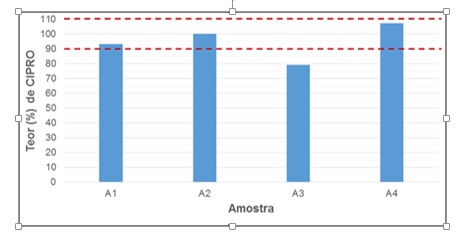
Teor individual encontrado para cada solução oftalmológica analisada.
Conclusões
Os resultados obtidos permitem a conclusão de que a avaliação de medicamentos antibacterianos faz-se necessária mediante a falta do controle de qualidade em laboratórios fabricantes destes fármacos. O método apresentou linearidade, exatidão, especificidade e precisão, apresentou baixo limite de detecção e quantificação para as amostras e concentrações utilizadas.
Agradecimentos
Ao IFMA Campus Monte Castelo e Ao GEA por todo suporte durante a realização desta pesquisa.
Referências
Agência Nacional de Vigilância Sanitária (ANVISA); Guia para Validação
de Métodos Analíticos e Bioanalíticos, Consulta Pública n° 129, de 12/02/2016.
AGÊNCIA NACIONAL DE VIGILÊNCIA SANITÁRIA (ANVISA). Guia para validação de métodos analíticos. Anvisa, Brasília, Resolução nº 899, 29/05/2003.
ARAUJO, K. C. M. Otimização e Aplicação de Metodologia Analítica Utilizando CLAE/FL para Monitoramento de Fármacos Antibacterianos Fluoroquinolônicos em Águas do Rio Anil Localizado na Cidade de São Luís – MA. Dissertação (Mestrado em Química Analítica), Universidade Federal do Maranhão. São Paulo, 2013.
NEVES, M. A. Avaliação da Qualidade de Anticoncepcionais Orais Comercializados em Farmácia de São Luís/MA. Monografia (Graduação), Universidade Federal do Maranhão. São Paulo, 2012.
































