Desenvolvimento de método de screening para determinação de 243 fármacos e pesticidas em amostras aquosas por LC-qTOF-MS
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Arsand, J. (UFRGS) ; Jank, L. (LANAGRO-RS) ; Dallegrave, A. (UFRGS) ; Galeazzi, C. (UFRGS) ; Barreto, F. (LANAGRO-RS) ; Hoff, R. (LANAGRO-RS) ; Pizzolato, T. (UFRGS)
Resumo
A contaminação dos sistemas aquáticos é motivo de preocupação devido ao elevado número de contaminantes emergentes possivelmente perigosos para o meio ambiente e para a saúde humana. A cromatografia a líquido acoplada à espectrometria de massas por tempo de voo (LC-qTOF-MS) fornece dados de espectro completo e alta resolução de massa com seletividade e sensibilidade adequadas para uma triagem ampla da amostra. Nesse trabalho, desenvolveu-se e validou-se método para a detecção de 243 fármacos e pesticidas em amostras aquosas. O preparo de amostra foi por extração em fase sólida, seguido de análise por LC-qTOF-MS. A validação foi realizada em dois níveis de concentração (0,1 e 1,0 μg L-1). A metodologia proposta foi eficiente na detecção da maioria dos compostos avaliados.
Palavras chaves
contaminantes emergentes; LC-qTOF-MS; método de screening
Introdução
Há mais de uma década, a identificação de compostos orgânicos, como fármacos, hormônios, pesticidas, produtos de higiene pessoais, entre outros, em efluentes urbanos e em águas superficiais, é uma das principais linhas de pesquisa em relação à qualidade da água (CALZA et al, 2013), pois existe um impacto direto destes compostos sob os humanos, animais e meio ambiente. Estes compostos em geral, são denominados “contaminantes emergentes” (DEBLONDE et al, 2011; MANDARIC et al, 2017). Contaminantes emergentes (CE) são substâncias utilizadas no nosso cotidiano e, na maioria das vezes, não apresentam dados ecotoxicológicos. De acordo com a definição da Agência de Proteção Ambiental Americana (EPA-US), os CEs são novas substâncias químicas, sem regulamentação legal, cujo impacto ambiental e à saúde humana pouco se conhece (DEBLONDE et al, 2011). O entendimento do destino e do comportamento de CEs no ambiente é fundamental para encontrar uma forma de melhorar a qualidade dos efluentes urbanos e, por consequência, melhorar os processos de tratamento de água potável (VIGLINO et al, 2008). Entre estes CEs, os fármacos e os pesticidas são de especial interesse, porque, apesar da baixa concentração, são introduzidos continuamente no ambiente, podendo assim promover efeitos adversos e acumulativos não previstos (DÍAZ-CRUZ et al, 2003). Uma vez na água, alguns deles são resistentes aos tratamentos utilizados nas Estações de Tratamento de Efluentes (ETEs) convencionais (NAIDU et al, 2016) . Subsequentemente, afeta as águas receptoras onde os compostos são liberados (KOSMA et al, 2010; OMAR et al, 2016). Os fármacos são moléculas bioativas que podem estar presentes nas águas. Uma vez administrados, podem ser excretados na sua forma inalterada, conjugados ou como metabólitos, chegando ao ambiente aquático através do esgoto doméstico, podendo assim se propagar e atingir águas superficiais (DÍAZ-CRUZ et al, 2003). Outras fontes de entrada destes compostos no ambiente são a disposição inadequada de medicamentos expirados, efluentes hospitalares e industriais, utilização na medicina veterinária, produção animal e aquicultura (CALZA et al, 2013 ; NAIDU et al, 2016; GAVRILESCU et al, 2015). Os pesticidas são usados principalmente para melhorar a produtividade na atividade agrícola. Vários deles são uma mistura de aditivos e ingredientes ativos (KÖCK-SCHULMEYER, et al, 2012). O escoamento das áreas agrícolas e a reutilização agrícola de lodo de esgoto ou adubo como fertilizante são uma importante fonte de contaminação ambiental (BARBOSA et al, 2016; DICHTL et al, 2007). Atualmente, o Brasil é o primeiro país em uso de pesticidas. Apesar da área continental do país, o clima tropical e a ocorrência de mais de uma colheita por ano são alguns fatores que contribuem para esse alto consumo (NIEMEYER et al, 2017). No que diz respeito à presença destes compostos no ambiente, eles são geralmente encontrados em águas superficiais e em efluentes domésticos em concentrações em nível de traços (µg L-1 e ng L-1) (SILVA et al, 2013). Métodos multirresíduos para fármacos e pesticidas são ferramentas muito úteis para determinar o perfil da ocorrência de CEs no ciclo da água em apenas uma análise. Considerando o nível de concentração extremamente baixo que estes compostos se encontram neste tipo de amostra, fazem-se necessários métodos com alta especificidade e sensibilidade. Para este fim, as melhores escolhas são métodos baseados em cromatografia líquida acoplada à espectrometria de massa (NAIDU et al, 2016; ACENA et al, 2015). A cromatografia a líquido acoplada à espectrometria de massas por tempo de voo (LC-qTOF-MS) apresenta um enorme potencial na análise qualitativa e confirmatória de contaminantes orgânicos em níveis de traços e ultratraços. A excelente precisão de massas juntamente com a aquisição de um conjunto de dados completo em relação aos componentes da amostra com alta sensibilidade facilita a realização de um screening de amplo escopo, seja na abordagem de compostos alvos, como não alvos (ACENA et al, 2015; BADE et al, 2016). Ainda, é possível realizar uma avaliação de dados já adquiridos a qualquer momento para pesquisar por compostos adicionais sem a necessidade de realizar uma análise adicional (HERNANDEZ et al, 2011). Em relação ao preparo de amostra, extração, clean-up e concentração são etapas extremamente importantes quando se trabalha com análise em nível de traços (OMAR et al, 2016). O protocolo mais frequente é a extração em fase sólida (SPE), devido ao baixo consumo de solventes orgânicos, à alta capacidade de concentração, aos vários tipos de adsorventes disponíveis e à grande diversidade de aplicações. No presente estudo, um método de triagem rápido para detecção e identificação de contaminantes emergentes foi desenvolvido e validado, utilizando preparo de amostra por SPE, seguido de análise por LC-qTOF-MS. O escopo do método abrange 243 fármacos e pesticidas em amostras aquosas ambientais e água potável.
Material e métodos
Foram utilizados padrões analíticos de maior pureza disponível. As soluções de padrão estoque foram preparadas na concentração de 1,0 mg mL-1. As soluções de trabalho foram preparadas por diluição direta de cada solução produzindo soluções de mistura em concentrações de trabalho de 1,0 μg mL-1. Para a validação do método, utilizou-se água de efluente urbano tratado coletado em uma estação de tratamento de efluente piloto pertencente ao Instituto de Pesquisa Hidráulica (IPH) da UFRGS, e água superficial coletada no Arroio do Salso, em Porto Alegre. As águas foram coletadas em garrafas de vidro âmbar e transportadas para o laboratório, onde foram filtradas utilizando filtros de membrana de celulose com tamanhos de poro diferentes (9, 5, 3, 1,2 e 0,45 μm) para posterior análise. O preparo de amostra foi realizado por extração em fase sólida (SPE), utilizando um protocolo adaptado de trabalho descrito previamente na literatura (JANK et al, 2014). Foram utilizados cartuchos Strata-X™ Polymeric Reversed Phase (33 μm, 200 mg, 6 mL) para pré-concentração e clean-up das amostras. O volume de amostra utilizado foi de 250 mL. Após eluição, o extrato foi concentrado e reconstituído com fase móvel a um volume final de 1,0 mL e 5,0 μL foram injetados no sistema LC-qTOF-MS. O sistema LC-qTOF-MS utilizado foi um Cromatógrafo Líquido Agilent 1100 Series acoplado a um Espectrômetro de Massa 5600 Sciex. A separação cromatográfica dos compostos foi realizada utilizando uma coluna analítica Acquity UPLC BEH Phenyl (2,1 × 50 mm, 1,7 μm), Waters. Utilizou-se uma fase móvel binária, onde o componente de fase móvel A foi uma solução aquosa 0,1% de ácido fórmico e o componente B foi acetonitrila com 0,1% de ácido fórmico. As amostras foram analisadas por ionização por eletrospray (ESI), tanto no modo positivo quanto no negativo, em dois diferentes métodos. O intervalo de m/z estabelecido para aquisição de dados foi de 100 a 1000 Da. A análise de dados foi feita pelo software Multiquant 2.1.1 Sciex. Para a validação do método, foi utilizado o protocolo de validação proposto por Diaz et al (DIAZ et al, 2013). A figura de mérito geral foi o limite de detecção de triagem (SDL), que representa o nível de concentração mais baixo testado para o qual um composto foi detectado em todas as amostras para uma determinada matriz e em um determinado nível (3 de 3). Outros parâmetros, como especificidade e seletividade, também foram avaliados. A validação foi realizada em quatro matrizes aquosas diferentes: água ultrapura (UP), água da torneira (TAP), água efluente (EW) e água superficial (SW). Para cada matriz, antes da extração, as amostras foram fortificadas com as soluções de trabalho. Foram analisadas três replicatas de amostras fortificadas a uma concentração de 0,1 μg L-1 e três replicatas a uma concentração de 1,0 μg L-1, juntamente com três amostras branco (não fortificadas).
Resultado e discussão
Métodos de screening baseados em espectrometria de massa de alta resolução
(HRMS) são muito úteis para a química ambiental devido a sua capacidade de
confirmar se uma substância está presente ou não em uma amostra em um
determinado nível de concentração (DIAZ et al, 2013). O uso de HRMS permite
um alto grau de confiança na identificação de compostos. Porém, alguns
critérios de identificação de compostos devem ser estabelecidos antes dos
ensaios de validação a fim de garantir a confiabilidade do método.
Devido à falta de um protocolo de validação para métodos de detecção de CEs
baseados em HRMS, alguns autores consideraram critérios específicos
(PORTELÉS et al, 2011; POZO et al, 2007). Esses critérios são baseados em
métodos de análise toxicológica e antidopagem, que possuem um número
relativamente grande de protocolos de validação de análise qualitativa
(LEENDERT et al, 2015).
Os principais critérios avaliados utilizando HRMS são a massa exata, através
da razão massa/carga (m/z), tempo de retenção (RT), fórmula empírica,
distribuição isotópica, m/z de íons fragmentados (MS2) e sua composição
elementar. A combinação desses fatores explica a potencial utilidade dos
sistemas qTOF como ferramentas de triagem.
Neste trabalho, os critérios para a identificação dos compostos foram
baseados em um mínimo de dois íons (m/z) em MS2 para cada analito, no tempo
de retenção (RT), na área do pico e no erro de massa. O tempo de retenção
esperado foi considerando como o tempo de retenção observado para cada
composto na solução padrão com uma meia janela RT de 15 s. Para a altura do
pico, foi considerado um mínimo de 70% da altura observada em padrão no
nível de concentração mais baixo. O erro de massa máximo aceitável foi de 5
mDa em todos os cromatogramas de íons extraídos.
A seletividade foi avaliada utilizando amostras com todos os compostos ao
mesmo tempo. O uso de LC-qTOF-MS associado aos critérios adotados para a
identificação do pico permitiu a seletividade do método muito satisfatório.
A Figura 1 mostra os cromatogramas de íons extraídos e o seu correspondente
espectro MS2 para alguns analitos detectados.
A análise por LC-qTOF-MS mostra alta especificidade, permitindo a
identificação de substâncias através da caracterização da massa exata dos
analitos de interesse com quatro dígitos decimais considerando um erro de no
máximo 5 mDa.
Na Figura 2, foram apresentados exemplos de dois isômeros de massa
(sulfadoxina e sulfadimetoxina). Ambos os analitos têm a mesma massa exata
(311.0814 Da). Além disso, como todas as sulfonamidas, o seu perfil de
fragmentação mostra íons característicos de m/z 156.0113 e 108.0443 Da.
Assim, o tempo de retenção e os fragmentos menores foram usados para
resolver esses dois analitos. A presença dos fragmentos 245.1 e 139.9 são
específicos para a sulfadoxina e podem ser observados no MS2 desta
sulfonamida.
A validação do método foi realizada com quatro matrizes aquosas (UP, TAP, EW
e SW), utilizando 243 compostos nas concentrações de 0,1 μg L-1 e 1,0 μg L-
1.
Alguns compostos foram detectados corretamente em apenas um nível de
concentração e alguns compostos não foram detectados em nenhuma das
concentrações adotadas, porém, a maioria dos analitos foi detectada
corretamente em todas as matrizes em ambos os níveis de concentração.
A possível razão para a detecção mal sucedida de alguns compostos tem
múltiplas causas. Alguns analitos podem não ficar retidos na etapa de SPE,
eluindo junto com a amostra. Outros analitos podem ser extraídos
corretamente no processo SPE, mas as condições cromatográficas ou de
ionização no espectrômetro de massa não são adequadas para suas
características intrínsecas. Também pode ocorrer de o analito ser extraído
adequadamente na etapa de SPE e resolvido de forma adequada na separação
cromatográfica, porém o método não é suficientemente sensível para permitir
sua detecção nas condições aplicadas. Assim, o método final é um compromisso
entre sensibilidade e amplo escopo. No entanto, modificações como aditivos
de fase móvel ou ajustes de pH no processo SPE podem levar a mudanças
drásticas na resposta de outros analitos, que anteriormente foram bem
resolvidos e detectados corretamente. Além disso, os detalhes de otimização
também podem levar a um aumento de complexidade, o que sempre evita os
métodos de triagem, quando possível.
O SDL foi determinado para a maioria dos compostos avaliados. Dos 243
contaminantes emergentes que foram utilizados, 188 compostos foram
detectados e identificados em água ultrapura (77,4%). Na água da torneira, a
detecção de foi 165 compostos (67,9%). Para as águas superficiais, 184
analitos foram considerados como validados (75,7%). Finalmente, na água de
efluente urbano, a detecção foi bem sucedida para 176 compostos (72,4%).
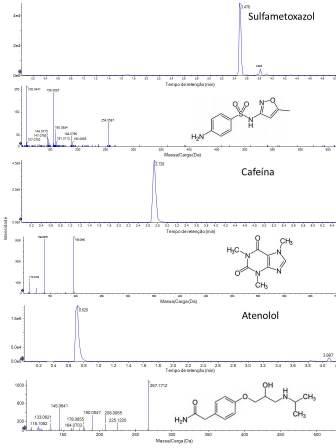
Cromatogramas de íons extraídos (XIC) e espectros de MS2 de sulfametoxazol, cafeína e atenolol.
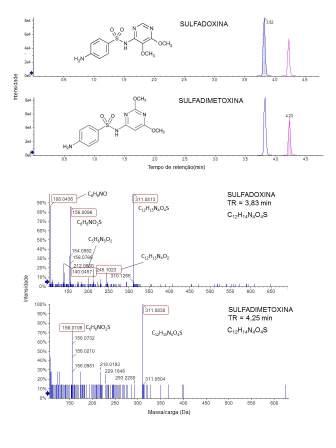
Cromatogramas de íons extraídos (XIC) e espectros de MS2 para os isômeros sulfadoxina e sulfadimetoxina.
Conclusões
Foi desenvolvido e validado método de triagem rápido e simples para detecção de 243 contaminantes emergentes, entre fármacos e pesticidas, em amostras aquosas. Foram incluídos quatro tipos de amostras de água no estudo de validação (água superficial, água de efluente urbano, água da torneira e água ultrapura). Um protocolo de preparação de amostras por SPE utilizando cartucho Strata-X™ foi proposto para extração, clean-up e concentração dos analitos em todas as matrizes. O uso do LC-qTOF-MS permitiu a detecção e identificação dos compostos com alta seletividade e especificidade devido à identificação pela massa exata de cada íon molecular. Esses dados, associados a informações adicionais, como o tempo de retenção, permitem a identificação correta mesmo de isômeros de massa. Mesmo no pior dos casos (água da torneira), mais de 160 compostos, incluindo fármacos e pesticidas, foram detectados e validados com sucesso.
Agradecimentos
Agradecemos à CAPES pela bolsa de doutorado de Juliana B. Arsand, e ao projeto PVE-CAPES-CNPq pelo suporte financeiro.
Referências
CALZA, P.; MEDANA, C.; PADOVANO, E.; GIANCOTTI, V.; MINERO, C. Fate of selected pharmaceuticals in river waters. Environ. Sci. Pollut., nº 20, 2262–2270, 2013.
DEBLONDE, T.; COSSU-LEGUILLE, C.; HARTEMANN, P. Emerging pollutants in wastewater: A review of the literature. Int. J. Hyg. Environ. Health, nº 214, 442–448, 2011.
MANDARIC, L.; DIAMANTINI, E.; STELLA, E.; CANO-PAOLI, K.; VALLE-SISTAC, J.; MOLINS-DELGADO, D.; BELLIN, A.; CHIOGNA, G.; MAJONE, B.; DIAZ-CRUZ, M.S.; SABATER, S.; BARCELO, D.; PETROVIC, M.Contamination sources and distribution patterns of pharmaceuticals and personal care products in Alpine rivers strongly affected by tourism. Sci. Total Environ, nº 590–591, 2017.
VIGLINO, L.; ABOULFADL, K.; PRÉVOST, M.; SAUVÉ, S. Analysis of natural and synthetic estrogenic endocrine disruptors in environmental waters using online preconcentration coupled with LC-APPI-MS/MS. Talanta, nº 76 1088–1096, 2008.
SILVA, A.K.; AMADOR, J.; CHERCHI, C.; MILLER, S.M.; MORSE, A.N.; PELLEGRIN, M. L.; WELLS, M.J.M. Emerging pollutants - Part I: Occurrence, fate and transport. Water Environ. Res., nº 85, 1978–2021, 2013.
DÍAZ-CRUZ, M.S.; LÓPEZ, D.A.; BARCELÓ, D. Environmental behavior and analysis of veterinary and human drugs in soils, sediments and sludge. TrAC - Trends Anal. Chem., nº 22, 340–351, 2003.
NAIDU, R.; ARIAS, E.; LIU, Y.; JIT, J. Emerging contaminants in the environment: Risk-based analysis for better management. Chemosphere, nº 154, 350–357, 2016.
KOSMA, C.I.; LAMBROPOULOU, D.A.;. ALBANIS, T.A. Occurrence and removal of PPCPs in municipal and hospital wastewaters in Greece. J. Hazard. Mater, nº 179, 804–817, 2010.
OMAR, T.F.T.; AHMAD, A.; ARIS, A.Z.; YUSOFF, F.M. Endocrine disrupting compounds (EDCs) in environmental matrices: Review of analytical strategies for pharmaceuticals, estrogenic hormones, and alkylphenol compounds. TrAC - Trends Anal. Chem, nº 85, 241–259, 2016.
GAVRILESCU, M.; DEMNEROVÁ, K.; AAMAND, J.; AGATHOS, S.; FAVA, F. Emerging pollutants in the environment: Present and future challenges in biomonitoring, ecological risks and bioremediation. New Biotechnol., nº 32, 147–156, 2015.
BARBOSA, M.O.; RIBEIRO, A.R.; PEREIRA, M.F.R.; SILVA, A.M.T. Eco-friendly LC–MS/MS method for analysis of multi-class micropollutants in tap, fountain, and well water from northern Portugal. Anal. Bioanal. Chem., nº 408, 8355–8367, 2016.
KÖCK-SCHULMEYER, M.; GINEBREDA, A.; GONZÁLEZ, S.; CORTINA, J.L.; DE, A.; BARCELÓ, D. Analysis of the occurrence and risk assessment of polar pesticides in the Llobregat River Basin (NE Spain). Chemosphere, nº 86, 8–16, 2012.
DICHTL, N.; ROGGE, S.; BAUERFELD, K. Novel strategies in sewage sludge treatment. Clean - Soil Air Water, nº 35, 473–479, 2007.
NIEMEYER, J.C.; CHELINHO, S.; SOUSA, J.P. Soil ecotoxicology in Latin America: Current research and perspectives. Environ. Toxicol. Chem., 2017.
ACEÑA, J.; STAMPACHIACCHIERE, S.; PÉREZ, S.; BARCELÓ, D. Advances in liquid chromatography - High-resolution mass spectrometry for quantitative and qualitative environmental analysis. Anal. Bioanal. Chem., nº 407, 6289–6299, 2015.
BADE, R.; CAUSANILLES, A.; EMKE, E.; BIJLSMA, L.; SANCHO, J.V.; HERNANDEZ, F.; DE, V. Facilitating high resolution mass spectrometry data processing for screening of environmental water samples: An evaluation of two deconvolution tools. Sci. Total Environ., nº 569–570, 434–441, 2016.
HERNÁNDEZ, F.; IBÁÑEZ, M.; GRACIA-LOR, E.; SANCHO, J.V. Retrospective LC-QTOF-MS analysis searching for pharmaceutical metabolites in urban wastewater. J. Sep. Sci., nº 34, 3517–3526, 2011.
DIAZ, R.; IBÁÑEZ, M.; SANCHO, J.V.; HERNÁNDEZ, F. Qualitative validation of a liquid chromatography-quadrupole-time of flight mass spectrometry screening method for organic pollutants in waters. J. Chromatogr. A., nº 1276, 47–57, 2013.
PORTOLÉS, T.; PITARCH, E.; LÓPEZ, F.J.; HERNÁNDEZ, F. Development and validation of a rapid and wide-scope qualitative screening method for detection and identification of organic pollutants in natural water and wastewater by gas chromatography time-of-flight mass spectrometry. J. Chromatogr. A., nº 1218, 303–315, 2011.
JANK, L.; HOFF, R.B.; DA COSTA, F.J.; PIZZOLATO, T.M. Simultaneous determination of eight antibiotics from distinct classes in surface and wastewater samples by solid-phase extraction and high-performance liquid chromatography-electrospray ionisation mass spectrometry. Int. J. Environ. Anal. Chem., nº 94, 1013–1037, 2014.
POZO, O.J.; VAN, E.; DEVENTER, K.; DELBEKE, F.T. Development and validation of a qualitative screening method for the detection of exogenous anabolic steroids in urine by liquid chromatography- tandem mass spectrometry. Anal. Bioanal. Chem., nº 389, 1209–1224, 2007.
LEENDERT, V.; VAN, L.; DEMEESTERE, K. Trends in liquid chromatography coupled to high-resolution mass spectrometry for multi-residue analysis of organic micropollutants in aquatic environments. TrAC - Trends Anal. Chem., nº 67, 192–208, 2015.
































