Determinação de carbamato de etila em cachaças: nas etapas de destilação e armazenamento em tonéis recém-confeccionados e recipiente de vidro
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Santiago, W.D. (UFLA) ; Cardoso, M.G. (UFLA) ; Barbosa, R.B. (UFLA) ; Lunguinho, A.S. (UFLA) ; Gonçalves, G.S. (UFLA) ; Cravo, F.D. (UFLA) ; Souza, R.H.Z. (UFLA)
Resumo
Entre vários compostos encontrados em cachaças, destaca-se o carbamato de etila (CE), por ser considerado um carcinógeno humano. Por não ser bem elucidada sua via de formação, alguns autores acreditam que ele venha do processo de fermentação, destilação e durante o armazenamento em tonéis de madeira. Os objetivos deste trabalho foram identificar e quantificar o CE em cachaças utilizando HPLC-FLD, no armazenamento em diferentes tonéis de madeira e recipiente de vidro, sem e com presença de luz. Na destilação, os níveis de CE variaram de <LQ a 17,081 µg L-1 e, no armazenamento contatou-se que os níveis aumentaram e apresentaram distintos. Nas bebidas estocadas em vidro, com presença ou ausência de luz, foi possível observar que o material e a luminosidade não afetaram a sua formação.
Palavras chaves
bebida alcoólica; contaminante orgânico; cromatografia
Introdução
A cachaça, por ser tradicionalmente a bebida popular brasileira mais consumida em nosso país, o conhecimento de sua composição química é importante, visto que os estudos dos compostos potencialmente tóxicos têm sido um fator determinante no controle de qualidade. Entre esses compostos, destaca-se o carbamato de etila (CE), por ser considerado um carcinógeno humano (LACHENMEIER, 2005; EFSA, 2007; CARDOSO, 2013). Desde o início do século foram encontrados teores relativamente altos, acarretando uma preocupação no Ministério da Saúde Brasileira. Esses resultados foram agravados por um estudo de avaliação de risco, mostrando que CE representa um risco significativo de câncer para a população brasileira que consome bebidas alcoólicas, com maior exposição resultante da cachaça (ANDRADE-SOBRINHO et al., 2002; LABANCA, GLÓRIA, E AFONSO, 2008; WEBER; SHARYPOV, 2009; LACHENMEIER et al., 2010; ZACARONI et al., 2011). O Canadá, em 1986 foi o primeiro país a introduzir limites máximos para a presença do CE em bebidas alcoólicas, sendo os limites máximos estabelecidos em bebidas de 30,00 µg L-1 para vinho, 100,00 µg L-1 para vinho fortificado, 150,00 µg L-1 para conhaque e uísque e 400,00 µg L-1 para aguardentes de fruta e licor. Esses limites estabelecidos pela Legislação canadense têm sido utilizados como referência em outros países, como os Estados Unidos, República Tcheca, França, Alemanha e Suíça. Assim, cada país passou a estabelecer seus próprios regulamentos, estabelecendo limites para este contaminante em relação à produção e importação de bebidas alcoólicas (EFSA, 2007; WEBER; SHARYPOV, 2009). A comparação entre os teores de CE em bebidas alcoólicas brasileiras com aqueles limites estabelecidos pelo Canadá foi inevitável, em função de esse país possuir legislação sobre o assunto e ser considerado como referência. Com isso, o MAPA estipulou por meio da Instrução Normativa n. 28, de 08/08/2014, que o limite máximo permitido para esse composto em aguardente e cachaça seja de 210 μg L-1. (BRASIL, 2005). As vias de formação e os precursores de CE em alimentos e bebidas dependem do tipo e do seu respectivo processamento. Ele é produzido em níveis baixos (ng L-1 ou ng kg-1até mg L-1) em alimentos fermentados, alimentos assados e bebidas alcoólicas por meio de vários precursores, tais como ácido cianídrico, cianeto, ureia, citrulina e aminoácidos N-carbamil (incluindo fosfato de carbamila por reação com etanol). (BRUNO et al., 2007; EFSA, 2007; WEBER; SHARYPOV, 2009; GALINARO et al., 2015). Por não ser bem elucidada sua via de formação alguns autores acreditam que ele venha do processo de fermentação, outros que sejam formados durante a destilação, atribuindo a esse processo forte evidências da relação entre o tipo de destilador (contínuo ou descontínuo), constituição de partes ascendentes e descendentes (cobre ou aço inoxidável), tipo de aquecimento (direto ou indireto), corte das frações (“cabeça”, “coração” e “cauda”) e taxa de refluxo durante o processo, aos níveis de CE encontrados. No entanto, alguns estudos apontam possível formação de CE durante o envelhecimento em tonéis de madeira (NÓBREGA et al., 2009; NÓBREGA et al., 2011). Anjos et al. (2011) identificaram e quantificaram o carbamato de etila em diferentes períodos de armazenamento da cachaça em tonel de carvalho (Quercus sp) e recipiente de vidro. Pelos resultados, observaram que CE apresentaram valores ascendente significativos ao longo do processo de envelhecimento e armazenamento em vidro. Os objetivos deste trabalhou foram identificar e quantificar o CE, utilizando a cromatografia líquida de alta eficiência com detector de fluorescência (HPLC-FLD), no armazenamento da cachaça em tonéis de carvalho (Quercus sp.), amburana (Amburana cearensis), jatobá (Hymenaeae carbouril), bálsamo (Myroxylon peruiferum), peroba (Paratecoma peroba) e recipiente de vidro, sem e com ausência de luz.
Material e métodos
Confecção dos tonéis Os tonéis foram confeccionados no município de Ponte Nova-MG, situado na região Zona da Mata Mineira. As madeiras amburana, bálsamo, carvalho, jatobá e peroba foram adquiridas pela tanoaria encarregada na fabricação dos tonéis. Todos os tonéis utilizados no estudo apresentavam um volume final de 20 litros cada um. Eles foram confeccionados nas seguintes dimensões: 40 cm de comprimento, 30 cm de altura, 102 cm de raio central e 1,8 cm de espessura da madeira. Produção e obtenção das amostras As amostras utilizadas foram produzidas no alambique da empresa Cachaça Artesanal João Mendes (JM), situada no município de Perdões/MG, no período da safra de 2014. A variedade de cana empregada foi a RB86-7515, o processo de fermentação foi realizado com fubá e, como micro-organismo, a levedura Saccharomyces cerevisiae. O preparo do fermento foi realizado por 5 dias e a fermentação do mosto de cana teve duração de 18 horas, em que o grau Brix inicial era 20º. Após o Brix zerar, o vinho foi destilado em alambique de cobre de 1000 litros. Na destilação, obtiveram 15 litros para fração “cabeça”, 180 litros para “coração” e 144 litros para “cauda”. Após a destilação, a fração “coração” foi transferida para os tonéis de carvalho, amburana, bálsamo, jatobá, peroba e recipiente de vidro incolor, sendo exposto em prateleira na presença de luz (claro) e envolto com papel alumínio (escuro). Nos tonéis foram estocados 20 litros e, nos vidros, 2 litros da bebida. Os tonéis foram mantidos em galpão fechado com temperatura e umidade do ar não controladas, colocados na posição horizontal para possibilitar o maior contato da bebida com a madeira e distanciados de outros tonéis para possibilitar as trocas gasosas. A cada dois meses, por um período de 12 meses, foram coletadas amostras de 2 litros e encaminhadas para a realização das análises cromatográficas, que foram realizadas no Laboratório de Análises de Qualidade de Aguardentes do Departamento de Química (DQI) da Universidade Federal de Lavras (UFLA). Determinação de carbamato de etila por HPLC-FLD A metodologia utilizada para a análise do CE foi realizada de acordo com a metodologia proposta por Anjos et al. (2011), Machado et al. (2013) e Santiago et al. (2014), que consiste na derivação prévia da amostra para a análise dessa substância. Análise estatística Utilizou-se o delineamento inteiramente casualizado (DIC) em esquema de parcelas subdivididas no espaço. Os dados obtidos foram submetidos à análise de variância, sendo as médias comparadas pelo teste de Schott Knott ao nível de 95% de confiança, usando o programa estatístico SISVAR (FERREIRA, 2011).
Resultado e discussão
Na Figura 1, está representado o cromatograma obtido do padrão de carbamato
de etila após a injeção de 20 µL e detecção de fluorescência.
De acordo com a Figura 1, o tempo de retenção médio obtido para o CE foi de
13,026 ± 0,193 minutos, valor próximo àquele encontrado por Anjos et al.
(2011), Zacaroni et al. (2011), Machado et al. (2013); Santiago et al.
(2014) e Zacaroni et al. (2015). A quantificação do CE nas amostras de
cachaça foi realizada por meio da construção de uma curva analítica obtida
por regressão linear (y = 11914,69x - 47197,63), sendo o coeficiente de
determinação (r2) obtido de 0,99996. Portanto, esse valor demostra a forte
correlação linear entre a concentração de CE e a área do pico obtida, e que
de acordo com a literatura, valores acima de 0,99 são aceitáveis (SNYDER;
KIRKLAND; GLAJCH, 1997; HARRIS, 2008).
Os limites de detecção (LD) e quantificação (LQ) foram estimados por meio
dos parâmetros obtidos para a curva analítica construída, sendo calculados
pelas respectivas relações matemáticas: LD = 3DP/m e LQ = 10DP/m (em que, DP
= estimativa do desvio-padrão da linha de regressão e m = coeficiente
angular da linha de calibração). Para esses limites, foram encontrados os
valores de 1,86 e 6,23 µg L-1, respectivamente. Sendo esses valores de LD e
LQ inferiores aos encontrados por Herbert et al. (2002) (4,2 g L-1 para
LD); Park et al. (2007) (20,0 g L-1 para LD); Anjos et al. (2011) (3,93 g
L-1 e 13,09 μg L-1), Zacaroni et al. (2011) (15,7 g L-1 e 52,5 g L-1),
Machado et al. (2013) (6,39 g L-1 e 21,32 g L-1); Santiago et al. (2014)
(3,24 µg L-1 e 10,83 µg L-1); Zacaroni et al. (2015) (3,81 µg L-1 e 11,53 µg
L-1) e próximo ao encontrado por Madrera e Valles (2009) (1,64 e 3,56 g L-
1).
Os valores de CE nos processos de destilação e armazenamento em toneis de
amburana, bálsamo, carvalho, jatobá e peroba e no armazenamento em vidro
estão apresentados na Tabela 1. Por meio dos resultados obtidos, pode-se
observar que a concentração de CE no processo de destilação variou de menor
que o limite de quantificação até 17,081 μg L-1, e ele apresentou abaixo do
limite permitido pela Legislação. Na literatura, várias referências
estabelecem relação entre os níveis de CE e seus sistemas de produção, e
para alguns autores, o processo de destilação é o de maior importância
(CARDOSO, 2013; ANJOS et al., 2011; SANTIAGO et al., 2014).
De acordo com Andrade-Sobrinho et al. (2009), os níveis de CE segue a ordem,
fração “cabeça” > “coração” > “cauda”, pelo fato de o CE ser mais solúvel em
etanol (1,2 g mL-1) que em água (0,10 g mL-1). Por esse fato, torna-se
previsível que a “cabeça” apresente uma maior concentração de CE, por ser a
fração com maior graduação alcoólica.
Esses resultados também corroboram aos encontrados por Santiago et al.
(2014), Borges et al. (2014) e Mendonça et al. (2016). Santiago et al.
(2014) avaliaram níveis de CE no caldo de cana, mosto fermentado e nas
frações da destilação. Os autores encontraram valores de não detectado para
caldo de cana e valores abaixo do limite de quantificação no mosto
fermentado e nas frações do destilado. Borges et al. (2014) avaliaram níveis
de CE, em diferentes mostos fermentados e destilados, de cachaças produzidas
com diferentes leveduras (espontânea e selecionada). Os autores concluíram
que os níveis de CE foram reduzidos no processo fermentativo e na destilação
quando se procede de maneira correta. Nas frações “cabeça”, foram
constatados os maiores níveis de CE. Posteriormente, Mendonça et al. (2016)
determinaram os níveis de CE em cachaças produzidas por diferentes tipos de
fermentação e seguiram sua formação durante as etapas de produção. Os
autores chegaram à conclusão de que as cachaças que continham farelo de
arroz como nutriente durante a fase de fermentação apresentaram os maiores
níveis de CE, tanto no processo fermentativo quanto no armazenamento,
decorrente do fato de o farelo de arroz conter compostos nitrogenados.
Pelos resultados obtidos, pode-se constatar que a concentração de CE nas
amostras de cachaça analisadas, na etapa de armazenamento, variaram de <LQ a
11,763 μg L-1, para o acompanhamento realizado com as cachaças armazenadas
nos tonéis de madeiras, e menor que o limite de quantificação para a cachaça
armazenada em recipiente de vidro, tanto na presença quanto na ausência de
luz. Estatisticamente, a concentração de CE, em todas as madeiras,
apresentaram aumento em sua concentração com o passar do tempo de
armazenamento; após 12 meses, os níveis de CE demostraram valores distintos
para cada tipo de madeira utilizada. Nota-se que, mesmo havendo um aumento
na concentração de CE ao longo do período de armazenamento, a concentração
desse contaminante esteve muito inferior ao limite máximo estabelecido pelo
MAPA (210 μg L-1). Diversos trabalhos com cachaças têm demonstrado a
presença de CE acima do limite máximo estabelecido pela Legislação (LABANCA;
GLÓRIA; AFONSO, 2008; BAFFA-JÚNIOR et al., 2007; ZACARONI et al., 2011;
MASSON et al., 2014; LELIS et al., 2014).
Apesar da baixa concentração encontrada ao longo dos 12 meses, nota-se uma
tendência de estabilização na concentração do CE para as cachaças
armazenadas nos tonéis de amburana, carvalho e jatobá. Esses resultados não
corroboram aos obtidos por Anjos et al. (2011), que avaliaram a concentração
de CE durante o armazenamento da cachaça em tonel de carvalho (Quercus sp) e
recipiente de vidro. Os autores observaram uma diferença significativa na
concentração de CE para ambos os procedimentos, percebendo-se um aumento
mais expressivo na concentração desse composto para a cachaça armazenada em
recipiente de vidro. Anteriormente, Madrera e Valles (2009), avaliando CE em
outra matriz, apontaram um aumento progressivo na concentração desse em
cidras submetidas a diferentes níveis de maturação. Santiago et al. (2014),
avaliaram CE em cachaças armazenadas em tonéis de amburana e carvalho por um
período de 12 meses, e os autores constataram que a concentração de CE se
manteve estabilizada e menor que o limite máximo permitido pela Legislação
desde o 1º mês de envelhecimento.
A formação de CE em cachaças durante o envelhecimento em tonel de madeira
ocorre de maneira gradativa, por meio da reação entre o etanol e a ureia
formada pela degradação de precursores nitrogenados, intrínsecos do processo
de produção da bebida, sendo os principais deles os aminoácidos arginina,
ornitina e citrulina. Além desses, outros compostos nitrogenados têm sido
estudados como possíveis precursores para a formação do CE antes e após o
processo de destilação, como é o caso do fosfato de carbamila e do íon
cianeto (BRUNO et al., 2007; WEBER; SHARYPOV, 2009).
Analisando os resultados das cachaças armazenadas em vidro, pode-se dizer
que estas não sofreram a influência do material e da luminosidade na
formação de CE. Esses resultados corroboram com os encontrados por Andrade-
Sobrinho et al. (2009), Galinaro e Franco (2011) e não corroboram com os
encontrados por Zacaroni et al. (2015). Zacaroni et al. (2015) estudaram a
influência da luz natural na concentração de CE em cachaças envelhecidas em
barris de madeira e armazenadas em garrafas de vidro por um período de 6
meses. Todas as amostras apresentaram uma concentração CE abaixo do limite
estabelecido pela Legislação brasileira. A maior concentração encontrada foi
de 79,70 µg L-1 e 70% das amostras exibiram uma influência da luz ou da
ausência de luz na análise desse composto. Com isso, inferiram que a luz
pode influenciar na formação desse composto.
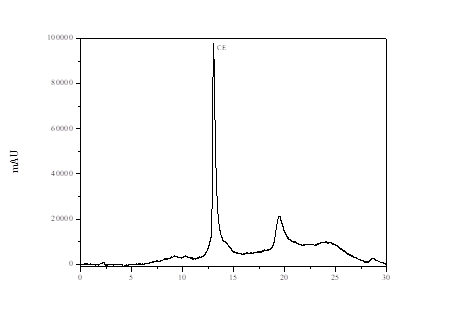
Cromatograma da solução padrão de carbamato de etila (CE), com detecção de fluorescência. Concentração do padrão injetado: 100,0 μg L-1
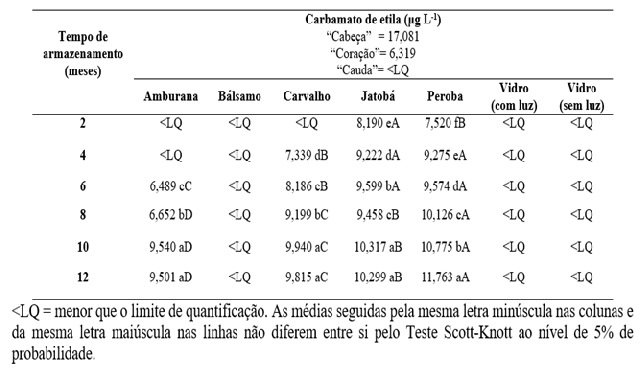
Concentração de carbamato de etila durante o processo de armazenamento da cachaça em tonéis de amburana, bálsamo, carvalho, jatobá, peroba e em vidro
Conclusões
As concentrações de CE na etapa de destilação, variaram de <LQ a 17,081 µg L- 1. No armazenamento em tonéis, contatou-se, que ao longo dos 12 meses, os níveis de CE aumentaram e apresentaram distintos quanto ao tipo de madeira. As bebidas estocadas no vidro, com presença ou ausência de luz, apresentaram valores abaixo do limite de quantificação, demonstrando que o material e a luminosidade não afetaram a formação de CE. De modo geral, as concentrações de CE avaliadas apresentaram valores baixos do limite estabelecido pela legislação, sendo assim apresentaram justificativas favoráveis para que as bebidas produzidas fossem aceitáveis ao consumo. Apesar dos bons resultados encontrados neste trabalho, vários estudos ainda são necessários para elucidar o caminho de formação do CE em alimentos fermentados e bebidas como cachaça.
Agradecimentos
Ao CNPQ, FAPEMIG, CAPES pelo apoio financeiro e bolsa concedida. À Cachaça Artesanal João Mendes, pela valiosa contribuição e por ceder as amostras de cachaças.
Referências
ANDRADE SOBRINHO, L. G. et al. Carbamato de etila em bebidas alcoólicas (cachaça, tiquira, uísque e grapa). Química Nova, São Paulo, v. 25, n. 6B, p. 1074-1077, 2002.
ANDRADE SOBRINHO, L. G. et al. Teores de carbamato de etila em aguardentes de cana e mandioca: parte II. Química Nova, São Paulo, v. 32, n. 1, p. 116-119, 2009.
ANJOS, J. P. et al. Identificação do carbamato de etila durante o armazenamento da cachaça em tonel de carvalho (Quercus sp) e recipiente de vidro. Química Nova, São Paulo, v. 34, n. 5, 874-878, 2011.
BAFFA JÚNIOR, J. C. et al. Ethyl-carbamate determination by gas chromatography – mass spectrometry at different stages of production of a traditional Brazilian spirit. Food Chemistry, London, v. 129, n. 4, p. 1383-1387, Dec. 2011.
BAFFA JÚNIOR, J. C. et al. Ocorrência de carbamato de etila em cachaças comerciais da região da zona da mata mineira – MG. Alimentos e Nutrição, Araraquara, v. 18, n. 4, p. 371–373, out./dez. 2007.
BORGES, G. B. V. et al. Selected Saccharomyces cerevisiae yeast strains and accurate separation of distillate fractions reduce the ethyl carbamate levels in alembic cachaças. Food Control, Guildford, v. 37, p. 380-384, Mar. 2014.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa n. 28, de 08 de agosto de 2014. Altera o subitem 5.1.2 do Anexo da Instrução Normativa nº 13, de 29 de junho de 2005, 2014.
BRUNO, S. N. F. et al. Influence of the distillation processes from Rio de Janeiro in the ethyl carbamate formation in Brazilian sugar cane spirits. Food Chemistry, London, v. 104, n. 4, p. 1345-1352, 2007.
CARDOSO, M. G. Produção de aguardente de cana. 3. ed. Lavras: Editora UFLA, 2013. 340 p.
EFSA – European Food Safety Authority. Ethyl carbamate and hydrocyanic acid in food and beverages. European Food Safety Authority, Parma, v. 551, p. 1–44, Oct. 2007.
FERREIRA, D. F. SISVAR: a computer statistical analysis system. Ciência e Agrotecnologia, Lavras, v. 35, n. 6, 1039-1042, 2011.
GALINARO. C. A.; FRANCO, D. F. Formação de carbamato de etila em aguardentes recém-destiladas; proposta para seu controle. Química Nova, São Paulo, v. 34, n. 6, p. 996-1000, 2011.
GALINARO, C. A. et al. Cyanate as an active precursor of ethyl carbamate formation in sugar cane spirit. Journal of Agricultural and Food Chemistry, Easton, v. 63, n. 33, p. 7415-7420, Aug. 2015.
HARRIS, D. C. Análise química quantitativa. 7. ed. Rio de Janeiro: LTC, 2008. 868 p.
HERBERT, P. et al. New HPLC method to determine ethyl carbamate in alcoholic beverages using fluorescence detection. Journal of Food Science, Chicago, v. 67, n. 5, p. 1616-1620, 2002.
LABANCA, R. A.; GLÓRIA, M. B. A.; AFONSO, R. J. C. F. Determinação de carbamato de etila em aguardentes de cana por CG-EM. Química Nova, São Paulo, v. 31, n. 7, p. 1860-1864, 2008.
LACHENMEIER, D. W. Rapid screening for ethyl carbamate in stone-fruit spirits using FTIR spectroscopy and chemometrics. Analytical and Bioanalytical Chemistry, Washington, v. 382, n. 6, p. 1407–1412, Aug. 2005.
LACHENMEIER, D. W. et al. Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaça and tiquira. BMC Câncer, London, v. 10, n. 266, p. 1-15, June 2010.
LELIS, V.G. et al. Ocorrência de carbamato de etila em cachaças de alambique e em aguardentes industriais. Revista Ceres, Viçosa (MG), v. 61, n. 4, p. 467-474, jul./ago. 2014.
MACHADO, A. M. R. et al. Determination of ethyl carbamate in cachaça produced from copper stills by HPLC. Food Chemistry, London, v. 138, n. 2-3, p. 1233-1238, June 2013.
MADRERA, R. R.; VALLES, B. S. Determination of ethyl carbamate in cider spirits by HPLC-FLD. Food Control, Guildford, v. 20, n. 2, p. 139-143, Feb. 2009.
MASSON, J. et al. GC-MS analysis of ethyl carbamate in distilled sugar cane spirits from the northern and southern regions of Minas Gerais. Journal of the Institute of Brewing, London, v. 120, n. 4, p. 516-520, Sept. 2014.
MENDONÇA, J. G. P. et al. Determination of ethyl carbamate in cachaças produced by selected yeast and spontaneous fermentation. Journal of the Institute of Brewing, London, v. 122, n. 1, p. 63-68, 2016.
NÓBREGA, I. C. C. et al. Ethyl carbamate in pot still cachaças (Brazilian sugar cane spirits): Influence of distillation and storage conditions. Food Chemistry, London, v. 117, n. 4, p. 693–697, Dec. 2009.
NÓBREGA, I. C. C. et al. Ethyl carbamate in cachaça (Brazilian sugarcane spirit): extended survey confirms simple mitigation approaches in pot still distillation. Food Chemistry, London, v. 127, n. 3, p. 1243–1247, Aug. 2011.
PARK, S. et al. Analysis of ethyl carbamate in Korean soy sauce using high-performance liquid chromatography with fluorescence detection or tandem mass spectrometry and gas chromatography with mass spectrometry. Food Control, Guildford, v. 18, n. 8, p. 975-982, July 2007.
SANTIAGO, W. D. et al. Ethyl carbamate in the production and aging of cachaça in oak (Quercus sp.) and amburana (Amburana cearensis) barrels. Journal of the Institute of Brewing, London, v. 120, p. 507-511, Aug. 2014.
SNYDER, L. R.; KIRKLAND, J. J.; GLAJCH, J. L. Practical HPLC method development. 2. ed. New York: J. Wiley, 1997. p. 542.
WEBER, J. V.; SHARYPOV, V. I. Ethyl carbamate in foods and beverages: a review. Environmental Chemistry Letters, Heidelberg, v. 7, n. 3, p. 233-247, Sept. 2009.
ZACARONI, L. M. et al. Caracterização e quantificação de contaminantes em aguardentes de cana. Química Nova, São Paulo, v. 34, n. 2, p. 320-324, 2011.
ZACARONI, L. M. et al. Effect of light on the concentration of ethyl carbamate in cachaça stored in glass bottles. Journal of the Institute of Brewing, London, v. 121, n. 2, p. 238-243, Mar. 2015.
































