ESTUDO DE DEGRADAÇÃO FORÇADA DO ÁCIDO FERÚLICO POR UHPLC-DAD
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Cabral Ferreira, J. (UFRN) ; Ilary Costa Duarte, F. (UFRN) ; Nascimento dos Santos, J.M. (UFRN) ; Quixabeira Leite, G. (UFRN) ; Andrade Nogueira, F.H. (UFRN) ; Lopes Porto, D. (UFRN) ; Arantes Ostrosky, E. (UFRN) ; Antonini Neves de Lima, A. (UFRN) ; Barreto Gomes, A.P. (UFRN)
Resumo
O ácido ferúlico (AF) é um ácido fenólico distribuído no reino vegetal. Estudos recentes sugerem muitas funções biológicas: atividade anticancerígena, proteção contra doenças coronarianas, por seu caráter antioxidante. Alguns testes e estudos são exigidos por órgãos como ANVISA e FDA, um desses é a pesquisa de produtos de degradação forçada. Um método de quantificação e identificação dos produtos de degradação do AF vem sendo desenvolvido por UHPLC-DAD. Os testes de estresse, são: Hidrólises (básica, ácida e neutra), oxidação e fotoestabilidade em solução. Os resultados obtidos até o momento indicam a estabilidade do AF frente ao estresse pelas hidrólises. Para a exposição a luz, o resultado obtido revela uma fortíssima instabilidade, possuindo degradação bastante considerável.
Palavras chaves
Ácido Ferúlico; Antioxidante; Degradação Forçada
Introdução
Pesquisas recentes realizadas pela Organização Mundial da Saúde (OMS) observaram o aumento na expectativa de vida das pessoas nas últimas décadas, estes índices tendem a crescer ainda mais. Essa elevação é consequência de hábitos de vida mais saudáveis, entre estes o maior cuidado com alimentação e a procura por produtos que combatem o envelhecimento. O interesse emergente no consumo de alimentos mais saudáveis contribui positivamente para isso, grande parte destes são ricas em moléculas bioativas. Estas moléculas apresentam altos níveis de polifenois e flavonoides que atuam das mais diversas formas na prevenção de doenças e no combate aos sinais da idade (NATTOH et al., 2016; PEREZ- TERNERO et al., 2017). O Ácido Ferúlico (AF) (ácido 4-hidroxi-3-metoxicinâmico) é um ácido fenólico abundante e encontrado em grãos integrais, espinafre, salsa, uvas e ruibarbo. O AF é formado a partir do metabolismo dos aminoácidos fenilalanina e tirosina, em formas livres, ou conjugadas a proteínas e polissacarídeos da parede celular vegetal (PERES, 2015; BEZERRA et al., 2016). O AF possui efeitos benéficos à saúde humana, evidências consideráveis apontam sobre propriedades antiinflamatórias, proteção cardiovascular, por ser um antioxidante muito potente, eficaz no combate dos radicais livres, por se tratar de um ácido fenólico hidroxiciânimico. Estudos recentes demonstraram a eficácia do AF contra os malefícios da radiação solar UVA e UVB, e concluíram que o AF previne os efeitos deletérios destas radiações em todas as camadas da pele, reduzindo a formação de eritema (característico da epiderme) e o fotoenvelhecimento (característicos da derme) (PERES, 2015; WU et al., 2017). O AF possui efeitos benéficos à saúde humana, evidências consideráveis apontam sobre propriedades antiinflamatórias, proteção cardiovascular, por ser um antioxidante muito potente, eficaz no combate dos radicais livres, por se tratar de um ácido fenólico hidroxiciânimico. Estudos recentes demonstraram a eficácia do AF contra os malefícios da radiação solar UVA e UVB, e concluíram que o AF previne os efeitos deletérios destas radiações em todas as camadas da pele, reduzindo a formação de eritema (característico da epiderme) e o fotoenvelhecimento (característicos da derme) (PERES, 2015; WU et al., 2017). A capacidade antioxidante do AF está ligada ao seu núcleo fenólico. Apesar de suas possíveis aplicações na terapêutica e seu uso bem estabelecido em formulações cosméticas alguns testes propostos pelos órgãos regulamentadores ainda não são realizados, como a quantificação de produtos de degradação forçada e devem ser feitos para garantir maior segurança e eficácia dessas formas farmacêuticas e das formulações (WANG et al., 2011; XI e LUO, et al., 2016). No Brasil o órgão regulamentador, ANVISA (Agência Nacional de Vigilância Sanitária), apresenta algumas Resoluções que tratam sobre o assunto, n° 58/2013; nº 45/2012; n° 1/2005 e o Informe Técnico nº 1/2008. A pesquisa e desenvolvimento de metodologias analíticas capazes de identificar, caracterizar e quantificar os produtos de degradação forçada do AF apresentam-se como muito inovadoras e indispensáveis. A realização destes testes é de fundamental importância, pois avaliam a perda de eficácia dos fármacos, medicamentos e das formulações cosméticas, formação de possíveis produtos tóxicos para a saúde humana controlando assim a qualidade dessa matéria-prima e formulações. Diante disto o presente trabalho busca o desenvolvimento, validação e emprego de técnicas analíticas simples, de baixo custo, que preservem os princípios da “Química verde” e que apresentem resultados confiáveis, neste contexto estimam-se o emprego da Cromatografia Líquida de Ultra Eficiência (CLUE). O emprego de metodologias analíticas com as características citadas proporcionará uma maior segurança, adequação as normas estabelecidas pela ANVISA e ICH, essa técnica também mostra-se eficiente na pesquisa de produtos de degradação forçada do ácido ferúlico nas matérias-primas, quando nas formas farmacêuticas e em futuras formulações cosméticas.
Material e métodos
AMOSTRA E REAGENTES - O Ácido Ferúlico (AF) foi doado pela Farmácia de Manipulação Pharma Face. Outros reagentes e solventes utilizado no preparo das soluções e fase móvel: Acetonitrila (ACN) J.T.Baker (grau HPLC) e água ultrapurificada (Milli-Q). EQUIPAMENTOS- Os cromatogramas iniciais foram obtidos UHPLC modelo CLUE-XR. O cromatógrafo é equipado com degaseificador DGU-20A3, sistema de bombas binário LC-20AD XR, auto amostrador SIL-20AC XR, forno da coluna CTO- 20AC, sistema de detecção na região do ultravioleta e visível DAD SPD- M20A, o módulo de comunicação com o computador será o CBM-20A.A coluna cromatográfica Kinetex® C18 (50 x 2.1 mm). Para o estudo de fotoestabilidade foi utilizado câmara Ethik® (Modelo 424/CF). DESENVOLVIMENTO DO MÉTODO ANALÍTICO- O procedimento analítico foi desenvolvido de acordo com as principais recomendações encontradas na literatura para análise de ácidos fenólicos por HPLC e UHPLC usando uma coluna e uma pré-coluna de fase reversa (C18) (PADILLA et al., 2005; SANTOS, 2009; WANG et al., 201; SILVA, 2012; BEZERRA et al., 2016). A amostra foi preparada pesando-se 10 mg de AF sendo solubilizada em uma proporção de 50:50 (50% Acetonitrila:50% solução utilizada para cada hidrólise ou peroxidação). A análise no UHPLC foi realizada em modo gradiente exploratório. Para a fase móvel foi utilizado ácido acético à 2% e ACN. O volume de injeção foi de 1 µL, a leitura foi realizada na região do UV-Visível em 322 nm. ESTUDO DE ESTABILIDADE E PESQUISA DE PRODUTOS DE DEGRADAÇÃO - •Estudo de degradação forçada: O estudo de degradação forçada do AF foi realizado seguindo-se os parâmetros recomendados pela ANVISA nas RDC n° 58/2013 e no Informe Técnico n° 1 de julho de 2008. O AF foi analisado em solução para o estudo de estresse. A degradação foi conduzida incluindo efeitos de hidrólise ácida, básica e neutra; oxidação e fotoestabilidade. •Hidrólise: As degradações por hidrólise foram realizadas na faixa de pH sugerida na RDC, com concentração de 0,1M de ácido clorídrico (HCl) para o ácida; e 0,1M de hidróxido de sódio (NaOH) para básica. Para a hidrólise neutra, a solução com AF foi submetida a hidrólise pela água ultra-pura. As soluções foram mantidas em temperatura ambiente e protegidas da luz. Para a oxidação realizou-se em solução de peróxido de hidrogênio (H2O2) a 4% de concentração (v/v). A solução foi mantida a temperatura ambiente e ao abrigo da luz. • Fotoestabilidade: O estudo de fotoestabilidade foi realizado nas soluções aquosas de AF com exposição a luz ultravioleta (UV) e à lâmpada fluorescente branca, numa câmara de fotoestabilidade Ethik® (Modelo 424/CF). Segundo estabelecido na opção 2 recomendada no ICH Q1B: para lâmpada fluorescente branca foi necessário produzir potência semelhante à especificidade ISO 10977 (1993). O teste foi realizado a temperatura ambiente e o tempo de exposição à luz estabelecido por pesquisas de revisão da literatura.
Resultado e discussão
•Hidrólise:
Para a hidrólise básica partiu-se de uma concentração de 0,1 M de NaOH,
como específica Informe Técnico 01/2008. Em todas as condições de
hidrólise foi utilizada AF em solução na concentração de 200 ppm em
proporção de 50:50 (50% Acetonitrila:50% da solução de NaOH). Os frascos
contendo as soluções foram levados a aquecimento (em banho-maria) à
temperatura de 60 ºC e agitação magnética. Em seguida, as amostras foram
executadas em gradiente exploratório de 5 à 100% de ACN, durante 30 min.
As coletas foram realizadas de hora em hora, partindo do A0 (Amostra no
tempo zero de reação) ao A16 (Amostra após 16h de reação) (Figura 1).
De acordo com a figura 1, é possível perceber que mesmo após a exposição
por 16 h não ocorreu degradação, porque não apareceu nenhum outro pico
no cromatograma, e não ocorreu modificação significativa no pico
principal do AF. Na tabela 1 podemos verificar os parâmetros
cromatográficos referentes à degradação alcalina em NaOH 0,1M. É
possível verificar a área do pico cromatográfico referente ao ácido
ferúlico e não verificar diminuição, o que não caracteriza degradação,
nem aparecimento de outro pico cromatográfico. Nadal e colaboradores
(2015) em seu estudo realizaram degradação forçada em micropartículas
com AF; nenhum pico adicional foi verificado nos cromatogramas
demonstrando que os produtos de degradação não foram detectados usando
condições cromatográficas otimizadas, apesar disto eles afirmam ter
ocorrido degradação de 16,33% das micropartículas de AF em NaOH 0,1M.
Para a hidrólise ácida partiu-se de uma concentração de 0,1 M de HCl,
como específica Informe Técnico 01/2008. As coletas foram realizadas à
cada 40 min, partindo do T0 (Amostra no tempo zero de reação) ao T20
(Amostra após 20 min de reação) e T40(Amostra após 40 min de reação)
(Figura 2). Silva (2014) em seu estudo de degradação forçada no
tenoforvir, realiza o teste de hidrólise ácida utilizando HCl 0,05M e
obtêm uma degradação considerável de quase 30%, a pesquisa explica que,
os ácidos catalisam a reação tornando o carbono da carbonila mais
eletropositivo (por protonação do oxigênio da carbonila). O tenofovir
trata-se de uma molécula bem maior, característica já conhecida dos
antirretrovirais, o AF é uma molécula de menor tamanho que possui menor
susceptibilidade a esse ataque induzido pelo HCl, mesmo quando mais
concentrado.
Os parâmetros cromatográficos podem ser observados na tabela 2. O
aumento na área dos picos nas amostras neste caso foram irrelevantes, no
decorrer do teste foi observada intensa volatilização das soluções
quando submetidas ao aquecimento, isso pode ter interferido diretamente
tornando as amostras com o passar do tempo, mais concentradas.
Após a análise dos cromatogramas e dos parâmetros cromatográficos é
possível afirmar que o AF quando exposto a estas condições por hidrólise
ácida, mostrou-se estável, pelo não aparecimento de outros picos no
cromatograma e não ocorreram modificações bruscas no pico característico
do ativo.
Para a hidrólise neutra utilizou-se para a degradação água ultra-pura.
As coletas foram realizadas à cada 3 h, partindo do AN0 (Amostra no
tempo zero de reação) ao AN6 (Amostra após 18 h de reação) e T40 (Figura
3).
A observação do cromatograma indica que não ocorreu degradação frente a
estas condições de reação por este período de tempo, não observada
alteração significativa no pico característico do AF e nem o surgimento
de novos picos, que indicariam presença de produtos de degradação. Para
reforçar este resultado torna-se importante a observação dos parâmetros
cromatográficos que estão representados na tabela 4.
Analisando os dados obtidos na tabela, com os valores dos parâmetros
cromatográficos percebe-se o que ficou claro na análise do cromatograma,
que a degradação neutra após 18 h de análise o AF possui estabilidade,
não possuindo alterações significativas ou surgimentos de novos
produtos.
Pesquisas anteriores, já citados neste estudo, realizadas com
micropartículas de AF (NADAL et al., 2015) e em nanopartículas de AF
(LIMA et al., 2017) realizaram estudos de estresse, mas a hidrólise
neutra não foi realizada em ambos os casos, tornando este o primeiro a
investir nesta análise.
Silva (2014) em seu estudo de degradação forçada no tenoforvir, afirma
que na hidrólise neutra, o nucleófilo geralmente é a água, e essa reação
geralmente ocorre mais lentamente. Fazendo um paralelo com o resultado
demonstrado neste teste de estresse, o tempo de análise utilizado pode
ter sido insuficiente para atestar a estabilidade em água do AF, devendo
posteriormente ser aumentado.
•Degradação oxidativa:
Na oxidação usou-se o peróxido de hidrogênio à 4%, o teste foi realizado
no UHPLC-DAD em gradiente exploratório de 0 à 30% de ACN em 30 minutos.
A concentração de AF para o estudo foi de 200 ppm. A degradação foi
realizada por 12h, com pontos de coleta a cada 3h. O cromatograma obtido
para essa condição de estresse encontra-se demonstrado na figura 4.
Para a observação da degradação através da área do pico, é possível
perceber que não ocorreu decaimento significativo (10 à 30%) do pico
principal do AF, nem de outros picos, os valores dos parâmetros podem
ser observados na Tabela 4.
Estudos anteriores realizados com nanopartículas contendo AF (LIMA et
al., 2017) mostrou o surgimento de um pequeno pico e anterioir ao pico
característico do AF, o que poderia ser justificado como um produto de
degradação, mas também como uma impureza, tendo em vista que não há
alteração no pico principal do AF.
Como é visto no cromatograma representado na figura 4, após 12 h de
exposição a oxidação, não ocorreu alteração significativa no tempo zero
e no final da reação. Observando o pico do AF podemos afirmar que não
houve degradação nesta condição de estresse. Ocorreu apenas um
decaimento na área do pico principal que precisa ser mais investigada.
•Fotoestabilidade:
A concentração de AF foi reduzida para 100 ppm e foi realizado em
gradiente exploratório de 0 a 30% de ACN em 30 min, As amostras foram
coletadas e o estudo foi realizado de 0 a 30 min, com coletas a cada 5
min, na câmara de fotoestabilidade. Essa degradação foi realizada em uma
solução contendo o AF (Figuras 5 e 6). A observação do cromatograma na
Figura 5 revela que após 5 min de exposição da solução do AF a 100 pmm
na câmara de luz UV foi obtida uma degradação significativa e o
aparecimento de um novo pico, além do principal do AF, sendo do produto
de degradação. Com isso fica claro a sensibilidade do AF a luz. O
cromatograma da Figura 6 evidencia que a degradação sob exposição a luz
é sustentada após os 30 min de análise, sem surgimento de novos picos,
mas com uma diminuição significativa do pico principal.
Neste teste além da análise na solução exposta a luz é realizada em uma
solução controle que é testada nos mesmos tempos, mas que fica protegida
da luz. No tempo de 5 min e de 30 min é possível perceber, pela
observação das figuras, que não houve degradação significativa da
solução controle. A Tabela 5 demonstra os valores dos parâmetros
cromatográficos obtidos para este estudo que reforçam a existência de
degradação bastante significativa.
Lima et al. (2017) em seu estudo com nanopartículas de AF observa que
este foi resistente a esta degradação, pela alta porcentagem de
recuperação obtido no estudo, ele acaba classificando estas
nanopartículas com estável. No entanto, é possível perceber que não é o
caso deste estudo, tendo em vista que além do decaimento significativo
do pico principal, ainda observamos o surgimento de um pico de impureza
(produto de degradação formado). No estudo citado a proteção pode
ocorrer através do sistema de nanopartícula utilizado, mas é conhecido
que o AF isoladamente é muito instável a luz, iniciando a degradação
após 5 min de estudo.
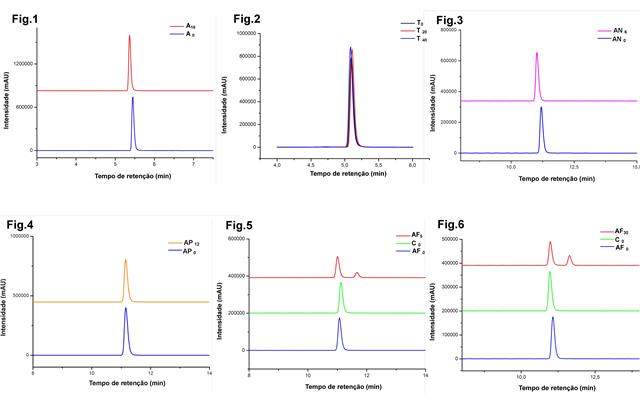
Fig1.Degradação básica.Fig2.Degradação ácida.Fig3. Degradação neutra.Fig4.Degradação oxidativa.Fig5 e Fig6.Degradação fotoestabilidade 5 min e 30 min.
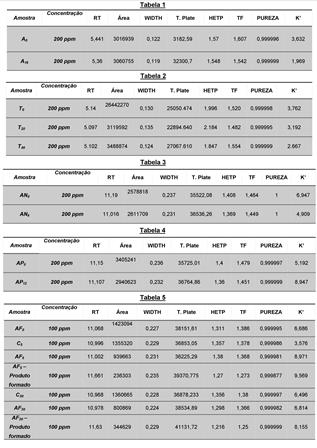
Tab1-Dados degradação alcalina.Tab2-Dados degradação ácida.Tab3-Dados degradação neutra.Tab4-Dados degradação oxidativa.Tab5- Dados fotoestabilidade.
Conclusões
Conclui-se que o AF é estável as hidrólises e a oxidação, entretanto quando exposto a degradação pela luz observou-se que o AF é bastante instável, degradando-se após 5 min de exposição.
Agradecimentos
Referências
BEZERRA, G.S.N.; BARBOSA, E.G.; ARAGÃO, C.F.S.; GOMES, A.P.B. et al. Compatibility study between ferulic acid and excipientes used in cosmetic formulations by TG/DTG, DSC and FTIR. JournalofThermalAnalysisCalorimetry, 2016.
BRASIL. ANVISA. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 45, de 9 de agosto de 2012. Dispõe sobre a realização de estudos de estabilidade de insumos farmacêuticos ativos.
BRASIL. ANVISA. Agência Nacional de Vigilância Sanitária. Resolução da Diretoria Colegiada RDC nº 58, de 20 de dezembro de 2013. Estabelece parâmetros para a notificação, identificação e qualificação de produtos de degradação em medicamentos com substâncias ativas sintéticas e semissintéticas, classificados como novos, genéricos e similares, e dá outras providências.
BRASIL. Ministério da Saúde. RE/ANVISA nº 166, de 25 de julho de 2017. Determina a publicação do "Guia para validação de métodos analíticos e bioanalíticos". Diário Oficial da União, Brasília, 2003.
BRASIL. Ministério da Saúde. RE/ANVISA nº 1, de 29 de julho de 2005. Publica o Guia para a Realização de Estudos de Estabilidade. Diário Oficial da União, Brasília, 2005.
BRASIL. Ministério da Saúde. Informe Técnico nº 1, de 15 de julho de 2008. Dispõe sobre os testes de estresse e esclarece sobre o item 2.9 do anexo da Resolução RE nº 1 de 29/07/2005, que trata do Guia para Realização dos Estudos de Estabilidade. Diário Oficial da União, Brasília, 2008.
DIAS, F. L. Desenvolvimento e validação de método indicador de estabilidade de formulações farmacêuticas de uso tópico contendo peróxido de benzoíla. p. 176, 2014.
GONÇALVES, U. E. D. E. Fluoroquinolínicos assistida por irradiação micro-ondas fluoroquinolínicos assistida por irradiação micro-ondas. P. 0–77, 2014.
ICH. Q1A (R2) Stability Testing of New Drug Substances and Products. 3ª ed. Expert Working Group (Quality) of the International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH), 2003.
ICH. Q1B Photostability Testing of New Drug Substances and Products. 5ª ed. Expert Working Group (Quality) of the International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH), 1998.
ICH – Harmonised Tripartite Guideline. Validation of Analytical methods texts and methodology Q2 (R1). In International Conference on Harmonization of Technical Requirements for Registration of Pharmaceutical for Human Use, 2005.
LANÇAS, F. M. A cromatografia líquida moderna e a espectrometria de massas: finalmente “compatíveis”. Scientiachromatographica, v. 1, n. 2, p. 35-61, 2009.
LIMA, I. A.; KHALIL, N. M.; MAINARDES, R. M. A stability-indicating HPLC-PDA method for the determination of ferulic acid in chitosan-coated poly(Lactide-co-glycolide) nanoparticles. BrazilianJournalofPharmaceuticalSciences, v. 53, n. 2, p. 1–10, 2017.
NADAL, J.M.; TOLEDO, M.D.A.; PUPO, Y.M.; DE PAULA, J.P.; FARAGO, P.V; ZANIN, S.M. Stability-Indicating HPLC-DAD Method for Determination of Ferulic Acid into Microparticles : Development, Validation , Forced Degradation , and Encapsulation Efficiency. v. 2015, p. 7–11, 2015.
NATTOH, G.; GATEBE, E.; MUSIEBA, F.; MATHARA, J. Bioprospecting optimal phenology for bioactive molecules in native Golden yellow Pleurotuscitrinopileatus Singer. Asian Pacific Journalof Tropical Biomedicine, p. 1 – 11, 2016
PERES, D.D. Ácido ferúlico em protetores solares: desenvolvimento e eficácia multifuncional in vitro, ex vivo e in vivo. 2015. 168 f. Tese (Doutorado em Farmácia) – Faculdade de Ciências Farmacêuticas, Universidade de São Paulo, São Paulo, 2015.
PADILLA. M.; PALMA, M.; BARROSO, C.G. Determination of phenolics in cosmetic creams and similiar emulsions. JournalChromatography A, v. 1091, p. 83 – 88, 2005
PORTO, H.S.M. HPLC versus UPLC: avaliação de aspectos críticos à transferência e validação de métodos analíticos. 2014. 118 f. Dissertação (Mestrado em Biotecnologia Farmacêutica) – Faculdade de Farmácia, Universidade de Coimbra, Coimbra, 2014.
SANTOS M. D. R. Desenvolvimento de método cromatográfico (HPLC-UV) para a determinação de ácidos fenólicos extraídos por ultra-som de forrageiras tropicais. 2009. 93 f. Dissertação (Mestrado em Química) – Departamento de Química, Universidade Federal de Juiz de Fora, Minas Gerais, 2009.
SILVA P. D. Determinação de compostos fenólicos por HPLC. 2012. 136 f. Dissertação (Mestrado em Química Industrial) – Departamento de Química Industrial, Universidade da Beira Interior, Covilhã, Portugal, 2012.
SILVA J. P. A. Estudo de estabilidade do antirretroviral tenofovir: uma abordagem integrada para o desenvolvimento de medicamento. 2014. 108 f. Dissertação de Mestrado (Programa de Ciências Farmacêuticas) – Departamento de Farmácia, Universidade Federal do Pernambuco, Recife, Brasil, 2014.
WANG, J.; CAO, Y.; SUN, B.; WANG, C. Characterisation of inclusion complex of trans-ferulic acid and hydroxypropyl-β-cyclodextrin. Food Chemistry, v. 124, p. 1069 – 1075, 2011.
WU, H.; LI, H.; XUE, Y.; LUO, G.; GAN, L.; LIU, J.; MAO, L.; LONG, M. High efficiency co-production of ferulic acid and xylooligosaccharides from wheat bran by recombinant xylanase and feruloyl esterase. Biochemical Engineering Journal, v. 120, p. 41 – 48, 2017.
XI, J.; LUO, S. The mechanism for enhancing extraction of ferulic acid from Radix Angelica sinensis by high hydrostatic pressure. SeparationandPurification Technology, v. 165, p. 208 – 213, 2016.
































