CONSTRUÇÃO DE SENSOR ÍON SELETIVO, PARA DETERMINAÇÃO POTENCIOMETRICA DE COBRE EM CACHAÇA
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Santos, H.C.F. (IF GOIANO) ; Nazareno, N.L.P. (IF GOIANO) ; Filho, A.C.P.M. (IF GOIANO) ; Jesus, A.P. (IF GOIANO) ; Ozanski, G.D. (IF GOIANO) ; Leão, H.L.S.L. (IF GOIANO) ; Castro, C.F.S. (IF GOIANO) ; Pereira, P.F. (IF GOIANO)
Resumo
A potenciometria é uma técnica bastante utilizada nos laboratórios através do pHmetro. Possui vantagens como: aplicação em amostras contendo pequenas concentrações do analíto e a facilidade no seu preparo. Neste trabalho foi desenvolvido um sensor de baixo custo, utilizando discos de HD como substrato, para a determinação potenciométrica de cobre em cachaça. A curva padrão de cobre com o eletrodo proposto alcançou R= 0,9986, obtendo 152,9 mg L-1 de cobre na cachaça.
Palavras chaves
Potenciometria; Eletrodo; Baixo custo
Introdução
A potenciometria é uma técnica bastante utilizada nos laboratórios através do pHmetro. Os eletrodos íons-seletivos tiveram a sua grande descoberta em 1966, quando Rossil, propôs um novo eletrodo para cálcio baseado em membrana líquida. A partir de então, novos eletrodos foram sendo desenvolvidos, com diversos materiais para diversas finalidades. (CESAR, et. al 2001). A potenciometria possui vantagens como: aplicação em amostras contendo pequenas concentrações do analíto, preparação da amostra geralmente simples, desaeração regularmente desnecessária (DA ROCHA et al, 1997), e pode ser realizada por material simples e de baixo custo, como CD’s de ouro e prata ( RICHTER et al 2003), placas de cobre impressa, entre outros (LOWINSOHN et al 2006). Este método é adequado para análise simultânea de metais, sem perda de resolução, quando suas concentrações variam em intervalo amplo de concentração (DA ROCHA et al, 1997). O cobre é um dos principais metais de transição, presentes no corpo humano, entretanto o seu excesso é nocivo, pois interfere diretamente na atividade de algumas enzimas catalíticas. O teor de cobre, permitido pela legislação brasileira é de 5 mg/L em bebidas alcoólicas e 1mg/L é o limite máximo permitido para água potável. (Ministério da Agricultura, 1974) Na literatura é encontrado métodos para quantificação de Cu na cachaça, tais como Voltametria de Redissolução Anódica (ASV), espectrometria de absorção atômica (AAS), espectrofotometria molecular no UV-Vis (PINTO et al 2005). No Brasil o método oficialmente aceito, é através da quantificação espectrofotométrica de absorção atômica com adição de padrão. Neste trabalho foi desenvolvido um sensor de baixo custo, utilizando discos de HD como substrato, para a determinação potenciométrica de cobre em cachaça.
Material e métodos
Todas as análises foram realizadas no Laboratório de Materiais e Eletroanalítica do IF Goiano – campus Rio Verde, em temperatura ambiente e as soluções foram preparadas com reagente CuSO4 (Vetec), H2SO4 (Neon), e com água deionizada. Para obtenção dos eletrodos de Cu a partir dos discos de HD, a camada magnética do HD, foi removida de modo abrasivo, com lixa d’água. A massa do disco de HD foi medida antes e depois da deposição, a diferença entre as massas é o valor do quanto de cobre foi depositada na superfície do eletrodo. A deposição de Cu na superfície do HD foi realizada e meio da solução eletrolítica CuSO4 2 molL-1 e H2SO4 0,01 mol L-1. O HD foi mantido nessa solução por 24 horas e a deposição ocorreu de forma espontânea. Para o teste de linearidade foi montado uma curva padrão nas concentrações de 0 a 24 mg L-1 as leituras foram realizadas com um multímetro simples e o tempo de estabilização foi 1 min e 30 seg. Para o teste de repetibilidade foram utilizadas as concentrações de 2 e 10 mg L-1 e a metodologia de leitura seguiu as mesmas da linearidade. Os resultados obtidos foram comparados com os obtidos por espectroscopia de absorção atômica modelo VARIAN AA240FS seguindo a metodologia para o cobre, lâmpada de catodo oco, corrente de 3,0 mA, comprimento de onda de 324,7 nm, fenda de 0,5 nm, chama de ar/ acetileno oxidante, curva-padrão de cobre preparada a partir da solução de sulfato de cobre (CuSO4) e a faixa de linearidade determinada com as concentrações de 0 a 20 mg L-1.
Resultado e discussão
A figura 1-a mostra o resultado do eletrodo após as 24 horas de deposição.
A faixa linear de trabalho foi entre 0 a 24 mg L-1, obtendo o coeficiente de
correlação R= 0,9986. A partir da tabela 1, observamos as características
analíticas do eletrodo em comparação com absorção atômica.
De acordo com a tabela 1, podemos observar que o eletrodo proposto, obteve
um coeficiente de correlação (R) ideal, de acordo Ribanni p. 773 2004, temos
que quando o coeficiente de correlação (R) for maior que 0,999, é uma
evidência de um ajuste ideal dos dados para a linha de regressão. Porém
notamos divergência entre os valores da concentração da amostra. O eletrodo
proposto não obteve uma constância entre a leitura da curva padrão com a
leitura da amostra, obtendo um valor em mg L-1 maior que o limite da curva
padrão.
Para o teste de repetibilidade, observamos que o eletrodo, não conseguiu
diferenciar as distintas concentrações de 2 e 10 ppm. Os valores em mV foram
muito próximos entre as concentrações. Os valores de desvio padrão relativo
(RSD) para a concentração de 2 ppm foi de 3% e 10 ppm 4%, mesmo que as para
as análises de traços e impurezas são aceitos um (RSD) de até 20% (RIBANNI,
2004), temos que o eletrodo não é capaz de detectar uma quantidade mínima de
cobre.

Figura 1: Imagem do eletrodo apos 24 horas de deposição.
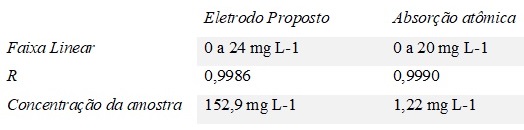
Tabela 1: : Comparação dos dados analíticos entre o eletrodo proposto e o absorção atômica. Fonte: Autores 2017.
Conclusões
O desempenho do eletrodo produzido, não foi conforme esperado, o mesmo não obteve estabilidade no processo de repetibilidade. No teste de linearidade foi obtido uma curva decrescente, entre a leitura da curva e a leitura da amostra, o eletrodo não conservou a estabilidade, obtendo um valor em mg L-1 de cobre na amostra, mais elevado que o limite da curva.
Agradecimentos
Agradecemos ao Instituto Federal Goiano – Campus Rio Verde e aos Laboratórios de Eletroanalítica e de Química Tecnológica – QUITEC
Referências
CESAR, J., et al. ELETRODOS ÍON-SELETIVOS: HISTÓRICO, MECANISMO DE RESPOSTA, SELETIVIDADE E REVISÃO DOS CONCEITOS, Química Nova, v. 24 n.1, p. 120–130, 2001.
DA ROCHA NOBRE, A. L.; MAZO, L. H. Análise potenciométrica de redissoluçãoo com ultramicroeletrodos - Fundamentos e aplicações na determinação de metais traços. Quimica Nova, v. 20, n. 4, p. 412–419, 1997
FOGUEL, M. V et al. Avalição da limpeza de CDtrodo construídos a partir de CD de ouro gravável/fita adesiva de galvanoplastia. Ecletica Quimica, v. 34, n. 2, p. 59–66, 2009.
Ministério da Agricultura; Complementação de Padrões de Identidade e Qualidade para Destilados Alcóolicos; Portaria nº 371; Brasília 1974.
PINTO, F. G. et al. Determinação de Cobre e Zinco em cachaça por espectrometria de absorção atômica com chama usando calibração por ajuste de matriz. Revista Analytica, v. 17, p. 48–50, 2005.
RIBANI, M. et al. VALIDAÇÃO EM MÉTODOS CROMATOGRÁFICOS E ELETROFORÉTICOS, Química. Nova, v. 27 n.5, p. 771–780, 2004.
RICHTER, E. M. et al. Aplicações eletroanalíticas com eletrodos de prata confeccionados a partir de CDs graváveis. Química Nova, v. 26, n. 6, p. 839–843, dez. 2003
































