VALIDAÇÃO DE MÉTODO ANALÍTICO PARA DETERMINAÇÃO DE TRIALOMETANOS EM ÁGUA POTÁVEL POR LLE E CG-MS
ISBN 978-85-85905-21-7
Área
Química Analítica
Autores
Silva, D.F. (UFVJM) ; Rodrigues, J.L. (UFVJM) ; Franco, E.S. (UFVJM) ; Pádua, V.L. (UFMG) ; Rodríguez, M. (UFVJM) ; Giani, A. (UFMG) ; Ferreira, A.F.A. (UFVJM) ; Júnior, I.C.S. (UFVJM)
Resumo
Neste trabalho um método simples e rápido foi desenvolvido e validado para determinar Trialometanos em amostras de água usando a Extração Líquido Líquido para quantificação por Cromatografia Gasosa acoplada à Espectrometria de Massas, oferecendo alta sensibilidade e seletividade. No estudo de validação foram obtidos baixos valores de precisão (desvio padrão relativo, RSD) 6,19%, 3,70%, 2,24%, 1,99% e bons valores de limite de detecção (LOD) 0,13 μgL-1, 0,02 μgL-1, 0,02 μgL-1 , 0,01 μgL-1 para o Triclorometano, Bromodiclorometano, Dibromoclorometano e Tribrometano, respectivamente. O método foi aplicado em amostras de água onde a cloração ocorreu junto a cianobactéria Microsistis Aeroginosa, semelhante à situação que ocorre no tratamento da água, detectando o Triclorometano.
Palavras chaves
Trialometamos; Cromatografia; Extração Liquido Liquido
Introdução
Conhecidos como subprodutos orgânicos da cloração (SPC) em Estações de Tratamento de Água (ETAs), os Trialometanos (TAMs), são principal classe de SPC voláteis na água tratada e uma das primeiras a serem descobertas, sendo portanto, a mais intensivamente estudada (CARDADOR et al., 2015; GRELLIER et al., 2015; LEE et al., 2010). No Brasil a soma das concentrações dos TAMs Triclorometano (TCM), Bromodiclorometano (BDCM), Dibromoclorometano (DBCM) e Tribrometano (TBM), foi estabelecida pela Portaria do Ministério da Saúde nº 36 em 1990, sendo mantida nas Portarias nº 1496 e nº 518. Tal valor foi reafirmado pela Portaria nº 2914/2011/MS, que limita seu valor máximo a 100 µg.L-1, vigorando até o presente momento (SAÚDE, 2011). Os TAMs são substâncias classificadas por agências internacionais como agentes carcinogênicos em seres humanos, na qual a importância da realização de trabalhos de avaliação do risco se torna extremamente necessária (FLORENTIN et al., 2011; GRELLIER et al., 2015; HANG et al., 2016; LEGAY et al., 2010; MISHRA; GUPTA; SINHA, 2014; PENTAMWA et al., 2013). Através dos métodos cromatográficos pode-se determinar os SPC, principalmente pela técnica de cromatografia a gás. Uma etapa de pré- concentração dos TAMs e outros subprodutos é necessária por estarem em baixas concentrações. Podem ser isolados da matriz aquosa pela técnica de Headspace, Purge and Trap (P&T) ou Extração Líquido-líquido (LLE), seguido pela determinação por detector de ionização por chama, FID (Flame Ionization Detector) para a determinação dos composto(CULEA; COZAR; RISTOIU, 2006; NIKOLAOU et al., 2002; PAVÓN et al., 2008; RIBANI et al., 2004). Sabendo da importância e dos problemas gerados pelos TAMs, métodos para a determinação dos compostos têm sido frequentemente estudados e aperfeiçoados, e embora o GC-ECD (cromatografia gasosa por detector de captura de eletrons) seja a base dos Métodos EPA, adaptações para detecção dos TAMs por GC-MS (cromatografia a gás acoplada à espectrometria de massa) pela extração LLE têm sido recomendadas. Porém, para que um método seja utilizado, ressalta-se quanto a necessidade de análise dos parâmetros analíticos para validação de métodos de separação. Para tal, incluem curva analítica, linearidade, seletividade, recuperação, limite de detecção e limite de quantificação, também conhecidos como parâmetros de desempenho analítico (ANVISA, 2003; COMISSÃO TÉCNICA DE QUÍMICA (CT-05), 2011; RIBANI et al., 2004). Esse trabalho validou, por meio da técnica de extração líquido- líquido (LLE) por GC-MS, uma metodologia para detecção de TAMs, com o objetivo de evitar desprendimento de recursos, insumos e instrumentação em agências responsáveis pelo tratamento e qualidade de água tratada, como COPASA, DAE e SAAE, além de institutos de pesquisa e universidades. Assim, este trabalho teve como objetivo o desenvolvimento e validação de um método simples, rápido e de baixo custo para determinação de TAMs (TCM, BDCM, DBCM e TBM) em amostras de água, bem como aplicação do método em amostras reais submetidas a processos de cloração na presença de cianobactérias Microsistis Aeroginosa, onde ocorre formação dos compostos.
Material e métodos
Foram utilizados reagentes de alto grau analítico e água ultrapura, esta 18.2 MΩ cm-1 obtida através do sistema de purificação de água da Thermo Scientific Barnstead Nanopure. Foram adquiridos padrões certificados de pureza cromatográfica de TAMs (TCM, BDCM, DBCM e TBM) (4M8140-U, TraceCERT®) e do padrão interno Fluorbenzeno (CRM48943, TraceCERT®), ambos de concentração 2000 µgmL-1 em metanol da marca Sigma. Para a extração LLE, metanol (646377) e Metil-Terc Butilico Éter (MTBE) (34875), também da Sigma e sulfato de sódio (Na2SO4) foram utilizados. As análises cromatográficas foram realizadas no laboratório Multiusuário do Instituto de Ciência, Engenharia e Tecnologia (ICET), da Universidade Federal dos Vales do Jequitinhonha e Mucuri (UFVJM). Foi utilizado um sistema de Cromatografia Gasosa acoplada á Espectrometria de Massas (GC-MS) o CLARUS 680 SQ 8PerkinElmer (USA) para as análises, empregando-se os padrões dos TAM para a detecção. As condições otimizadas para o CG foram: 2 µL de amostra injetada no modo splitless e separados por coluna capilar ZEBRON ZB–5MS (30m x 0,25mm x 0,25µm) 5% Polysilarylene – 95% Polydimethylsiloxane. A temperatura do injetor foi 200 ºC, gás de arraste o hélio de grau de pureza 99,9995% e fluxo do gás de arraste a 1,0 mL.min-1 (fluxo constante). O forno foi programado isotermicamente a 35ºC por 1 min e, em seguida aumentada para 40ºC a uma velocidade de 1ºC/min durante 1 min, seguido de aquecimento de 30 ºC/min até 200ºC. O MS foi usado no modo de impacto de elétrons (EI+). O tempo de corte do solvente foi a 3,00 min e a velocidade de aquisição foi de 0,35 s/ scan, intervalo de leitura m/z de 45 a 260 u.m.a. e modo de ionização de impacto eletrônico 70 eV. A temperatura da linha de transferência foi de 200ºC e a temperatura do trap de 180ºC. Para construção da curva de calibração, bem como no estudo da linearidade do método, foram preparadas concentrações nos valores desde 1, 2, 5, 10, 20, 40, 60, 80, 150 e 200 μgL-1, além de 400, 600, 800 e 1000 μg.L-1 para os elementos TCM, BDCM, DBCM e TBM. Foi feita a determinação em triplicata, para elaboração de curvas analíticas de calibração e, posteriormente, levantamento dos parâmetros para validação do método. As diluições foram rapidamente coletadas e inseridas em frascos do tipo âmbar de 100 mL, ao qual foi adicionado um volume de 50 µL de padrão interno Fluorbenzeno diluído e 4 mL de MTBE, mantido a 4 °C, e aproximadamente 1,0 g de sulfato de sódio puro, agente secante da fase orgânica. O frasco vial foi agitado vigorosamente por 5 minutos e imediatamente acondicionado em freezer à -4°C. Duas fases, bem definidas, foram formadas dentro do frasco âmbar: a fase orgânica superior, chamada de extrato e a fase inferior, chamada de fase aquosa. A fase orgânica foi retirada e transferida para um frasco tipo vial de 2 mL, acondicionada em freezer e conservada para análise em CG-MS.
Resultado e discussão
Otimização de condições de extração e cromatográficas
Foram realizados ensaios de extração para a determinação do volume de
amostra para verificação da recuperação analítica e padronização do
procedimento, através da intensidade do sinal. PAVÓN et al., (2008)
mencionam alguns trabalhos usando volumes de amostra entre 5 e 100 mL em
diversas adaptações da literatura. O volume ideal para a preparação,
extração e análise de TAMs foi de 50 mL, de acordo com o melhor resultado
detectado pelo GC-MS. A partir desse volume, não se observou formação de
fase.
A otimização da rampa de aquecimento foi realizada seguindo os valores
monitorados por (CARDADOR; FERNÀNDEZ-SALGUERO; GALLEGO, 2015; CULEA; COZAR;
RISTOIU, 2006; NIKOLAOU et al., 2002; PAVÓN et al., 2008) para a
identificação dos TAMs. Foi então feita a otimização das corridas na
separação de TCM, BDCM, DBCM e TBM. Os valores otimizados são mostrados na
figura 1.
Curva analítica e linearidade
A curva de calibração analítica foi construída utilizando concentrações com
valores variados, indicados na metodologia por dois operadores para os
quatro TAMs. A partir dos resultados da regressão linear (y = ax + b)
obtidos pela curva de calibração (1 a 200 μg L-1), observamos uma
similaridade dos resultados com diferentes operações (Tabela 1) com
respostas lineares e correlações acima do que CULEA et al., (2006) e PAVÓN
et al., (2008) recomendam para os intervalos de concentração estudados.
Verificou-se que houve uma boa linearidade quando foram utilizadas
concentrações de 1 a 1000 μg L-1 com correlações superiores as sugeridas por
(ANVISA, 2003; INMETRO, 2011).
Precisão
A precisão foi obtida estimando o desvio padrão relativo (RSD) em dois
níveis diferentes: repetitividade e intermediário. Nos métodos de análise de
traços ou impurezas, o RSD é aceito até 20%, dependendo da complexidade da
amostra. A precisão de repetitividade foi avaliada por injeções feitas no
mesmo dia em uma amostra de 200 μg L-1. Na Tabela 1, é possível observar a
similaridade dos resultados e concluir que o RSD foi inferior a 2%, dentro
do limite aceitável (20%). Para a precisão intermediária, avaliada por
injeções em dias diferentes em amostras de 200 μg L-1, o RSD foi inferior a
7%, também dentro do limite aceitável de 20% (ANVISA, 2003; INMETRO, 2011).
Limite de detecção (LOD) e Limite de quantificação (LOQ)
Foram obtidos pelo método dos parâmetros da curva analítica (RIBANI et al.,
2004). Conforme observado na Tabela 1, o método é capaz de detectar e
quantificar baixas concentrações, permitindo maior confiança nos resultados
(Tabela 1).
Exatidão
Os valores de recuperação (Tabela 2) foram obtidos em 3 concentrações
diferentes (80, 150 e 200 μg L-1), com resultados variando de 95,98% a
110,77%. Os intervalos aceitáveis de recuperação para análise de resíduos
geralmente estão entre 70 e 120%, com precisão até ± 20%. Com a curva de 1 a
200 μgL-1, foi possível estimar os valores esperados em função das respostas
das injeções nas concentrações sugeridas, com valores próximos aos de
interesse. O RSD também foi calculado, oferecendo valores satisfatórios
(menos de 2%). Deve-se enfatizar que materiais de referência certificados
foram utilizados para garantir a qualidade do processo de validação
analítica.
Seletividade
A seletividade foi definida pela comparação da matriz da substância com a
adição do composto ácido 2,2-dicloropropiónico. Não houve interferência no
tempo de retenção de TAMs, mantendo a característica de estar bem separados
durante o cromatograma e indicando a seletividade da metodologia proposta.
Discussão
A sequência de TCM, BDCM, DBCM e TBM é explicada pelo fato que os compostos
apresentam características químicas distintas. O TCM, com a massa molar
menor, é detectado na coluna dentro de um intervalo de tempo mais curto,
enquanto o TBM é o último composto a aparecer devido à sua massa molar maior
do que a dos outros TAMs. Outras características, como ponto de ebulição e
ponto de fusão, validam o resultado, conforme descrito na Tabela 3.
Nos trabalhos (APHA, 2012; EICHELBERGER et al., 1990; MUNCH; HAUTMAN, 1995)
são descritas diferentes metodologias analíticas para a quantificação de
TAMs. Diferentes tempos de retenção podem ser explicados pelo uso de
diferentes colunas. Nikolaou et al., (2002) usaram a coluna do tipo HP-VOC
(60 m × 0,32 mm ID × 1,8 μm) e CULEA et al., (2006) usaram a coluna de mesma
especificação da usada no neste trabalho, mas de outro fabricante (RTX-5MS
Coluna capilar, 30 m × 0,25 mm × 0,25 μm ), o que leva à conclusão de que
cada fabricante fornecerá em uma mesma condição rampas com diferentes tempos
de retenção. O que varia nessas colunas são as fases com as quais elas são
construídas.
Outra justificativa para a variação na eficiência da separação e o
desempenho obtido neste estudo pode estar relacionada ao gás utilizado como
fase móvel. Assim, é importante a escolha do gás a ser utilizado. O gás deve
ser inerte e alta pureza (99,999%), uma vez que impurezas como ar, umidade e
traços de vapores de hidrocarbonetos podem danificar a coluna cromatográfica
e reagir com a amostra. Os mais usados como gás de arraste GC são:
nitrogênio (N2), hidrogênio (H2) e hélio (He) (GROB L ROBERT AND BARRY F
EUGENE, 2004).
Um detalhe importante é o uso do padrão interno. O padrão de Fluorobenzeno
aqui usado apresenta um custo menor do que o halotano usado por CULEA et
al., (2006) e outros autores, proporcionando vantagens econômicas em países
com obrigatoriedade de detecção nas portarias de potabilidade como o Brasil.
Nikolaou et al.(2002) realizou estudos em que a técnica de pré-concentração
de LLE foi utilizada para medir TAMs e outras SOH na água em cinco níveis de
concentração, variando de 1 a 50 μg L-1. Na maioria dos estudos, os autores
usaram uma modificação do método EPA 555.1 e compararam o LLE-GC-ECD com
outras técnicas (LLE-GC-MS, P&T-GC-MS e HS-GC-MS). O método LLE-GC-ECD foi o
mais sensível para a medição de todos os compostos estudados, seguido por
LLE-GC-MS, embora os autores não tenham observado diferença significativa no
aspecto de recuperação desses dois métodos. A técnica LLE-GC-ECD é
normalmente mais sensível do que o LLE-GC-MS, no entanto, a principal
vantagem do detector MS é a capacidade de identificar os compostos
detectados nas amostras. P&T-GC-MS apresentou bons resultados e HS-GC-MS
obteve recuperações aceitáveis, mas maior LOD.
Culea et al. (2006) determinou em concentrações 20, 40, 60, 80, 100, 200,
300 e 400 μg L-1 dos quatro TAMs por LLE-GC-MS, utilizando o padrão interno
de halotano . O autor comparou os resultados com outras técnicas (P&T-GC-MS
e HS-GC-MS) e apesar de identificar o último como a mais sensível, a
extração de LLE-GC-MS mostrou ser mais eficiente. Em comparação com o
estudo, obtivemos melhores coeficientes de regressão, limite de detecção de
1 μg L-1, sendo que os estudos LLE começaram a detectar após 20 μg L-1 com a
recomendação de usar outras técnicas de extração (P&T e HS) para maior
confiabilidade .
Embora HS e P&T estejam entre as escolhas preferenciais devido à sua
automação, outras técnicas, como LLE oferecem um desempenho mais fácil com
um investimento menor. Comparando com outros trabalhos na literatura, a
configuração do LLE-GS-MS oferece agilidade na extração, além de requerer
menos automação do que o HS-GC-MS e o P&T-GC-MS.
Ressalta-se a questão do volume da amostra no estudo, o qual foi feito em
função da sensibilidade, demonstrando que o volume da amostra apresenta
interferência na analise dos compostos. No estudo de (NIKOLAOU et al., 2002)
e (CULEA et al., 2006), foram utilizados volumes menores (50 mL), permitindo
a possibilidade de interferência na sensibilidade.
A aplicação do método em amostras reais cloradas na presença de Microcystis
aeruginosa, condição semelhantes às que ocorrem em ETAs, detectaram 59,69 μg
L-1 do TCM. Assim, é extremamente relevante avaliar a extensão dos efeitos
da cloração nas células Microcystis aeruginosa no tratamento de água.
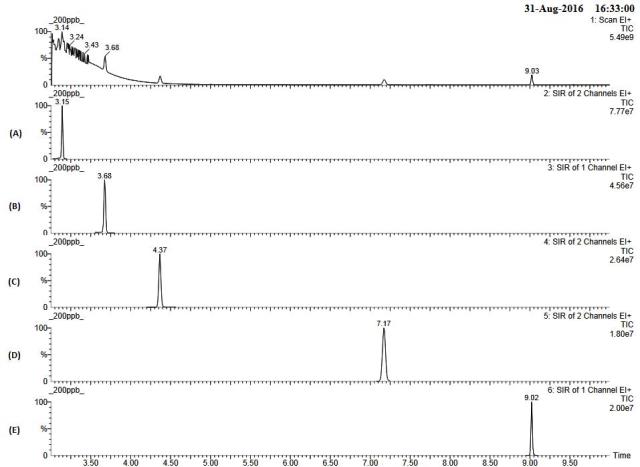
Modelo de rampa TIC e SIR obtido a partir da otimização de rampa TAM's: (A)TCM; (B)padrão interno de fluorobenzeno;(C)BDCM; (D)DBCM; (E)TBM; 200 μgL-1.
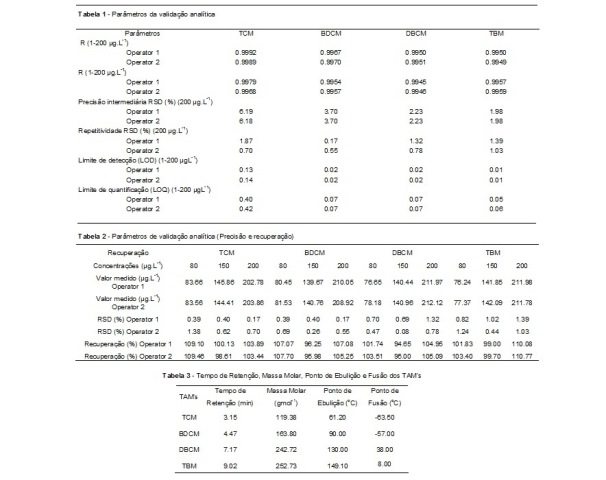
Parâmetros da validação analítica
Conclusões
A validação por LLE-CG-MS se mostrou satisfatória utilizando os parâmetros de validação discorridos nesse artigo, sendo, portanto possível à aplicação em ETA com menores recursos financeiros do que as técnicas P&T-CG-MS e HS-CG-MS. O detector MS se mostrou sensível, com baixas interferências (ruídos) ao redor da posição de detecção dos TAM. Ainda mostrou-se de extrema importância, a verificação da sensibilidade através da variação do volume de extração antes da validação de qualquer método. Foi feita a aplicação do método em amostras reais cloradas na presença de Microcystis aeruginosa, sendo detectada a presença do TCM. O método desenvolvido e validado apresentou-se eficiente na aplicação em amotras reais, com boa sensibilidade, precisão e ótima resposta analítica, de fácil aplicação em processo de monitoramento de subprodutos da cloração.
Agradecimentos
Os autores agradecem a Fapemig, a Fundação Nacional de Saúde (FUNASA) e a CAPES pelo apoio financeiro e bolsas de estudo.
Referências
ANVISA. Guía para validação de métodos analíticos e bioanalíticos. Resolução RE n 899, 29 de maio de 2003, p. 1–15, 2003.
APHA, A. W. Standard Methods for examination of water and wastewater. 22nd ed. Washington: American Public Health Association. [s.l: s.n.].
CARDADOR, M. J.; FERNÀNDEZ-SALGUERO, J.; GALLEGO, M. Simultaneous quantification of trihalomethanes and haloacetic acidsin cheese by on-line static headspace gas chromatography-massspectrometry. Journal of Chromatography A, v. 1408, p. 22–29, 2015.
CULEA, M.; COZAR, O.; RISTOIU, D. Methods validation for the determination of trihalomethanes in drinking water. Journal of Mass Spectrometry. Anais...2006
EICHELBERGER, J. W. et al. Determination of volatile organics in drinking water with USEPA method 524.2 and the ion trap detector. Journal of Chromatographic Science, v. 28, n. 9, p. 460–467, 1990.
FLORENTIN, A.; HAUTEMANIÈRE, A.; HARTEMANN, P. Health effects of disinfection by-products in chlorinated swimming pools. International Journal of Hygiene and Environmental Health, v. 214, n. 6, p. 461–469, 2011.
GRELLIER, J. et al. Assessing the human health impacts of exposure to disinfection by-products – a critical review of concepts and methods. Environ Int, v. 78, p. 61–81, 2015.
GROB L ROBERT AND BARRY F EUGENE. Modern Practice of Gas Chromatography, Fourth Edition. [s.l: s.n.].
HANG, C. et al. Occurrence and health risk assessment of halogenated disinfection byproducts in indoor swimming pool water. Science of the Total Environment, v. 543, p. 425–431, 2016.
INMETRO. Orientação sobre validação de métodos analíticos. Inmetro, p. 20, 2011.
LEE, J. et al. Production of various disinfection byproducts in indoor swimming pool waters treated with different disinfection methods. International Journal of Hygiene and Environmental Health, v. 213, n. 6, p. 465–474, 2010.
LEGAY, C. et al. Estimation of chlorination by-products presence in drinking water in epidemiological studies on adverse reproductive outcomes: A reviewScience of the Total Environment, 2010.
MISHRA, B. K.; GUPTA, S. K.; SINHA, A. Human health risk analysis from disinfection by-products (DBPs) in drinking and bathing water of some Indian cities. J Environ Health Sci Eng, v. 12, n. 1, p. 73, 2014.
MUNCH, D.; HAUTMAN, D. Method 551.1: Determination of chlorination disinfection byproducts, chlorinated solvents , and halogenated pesticides/ herbicides in drinking water by liquid-liquid extraction and gas chromatography with electron-capture detection. Environmental Protection, p. 1–61, 1995.
NIKOLAOU, A. D. et al. Application of different analytical methods for determination of volatile chlorination by-products in drinking water. Talanta, v. 56, n. 4, p. 717–726, 2002.
PAVÓN, J. L. P. et al. Determination of trihalomethanes in water samples: A review. Analytica Chimica Acta, v. 629, n. 1–2, p. 6–23, 2008.
PENTAMWA, P. et al. Cancer Risk Assessment from Trihalomethanes in Community Water Supply at Northeastern Thailand. International Journal of Environmental Science and Development, v. 4, n. 5, p. 538–544, 2013.
RIBANI, M. et al. Validation for chromatographic and electrophoretic methods. Quimica Nova, v. 27, n. 5, p. 771–780, 2004.
SAÚDE, M. DA. Portaria 2914/2011. Diário Oficial da União, v. 2011, p. 1–16, 2011.
































