AVALIAÇÃO DO PROCESSO ELETROQUÍMICO OXIDATIVO AVANÇADO NO TRATAMENTO DE EFLUENTES TÊXTEIS CONTENDO CORANTE REATIVO PRETO 5
ISBN 978-85-85905-21-7
Área
Ambiental
Autores
Fernandes Viana, D. (UNIT) ; Richard Salazar-banda, G. (UNIT) ; Soares Aristides, S. (UNIT) ; Souza Leite, M. (UNIT)
Resumo
A necessidade de novos métodos de tratamento de efluentes têxteis é crucial para a preservação do meio ambiente. Processos eletroquímicos oxidativos avançados tem ganhado muita atenção nos últimos anos, uma vez que é considerado uma alternativa limpa, na qual seu principal reagente é o elétron. Deste modo, neste trabalho são utilizadas técnicas estatísticas para a otimização de um sistema eletroquímico da degradação do corante Reativo Preto 5 utilizando ânodo dimensionalmente estável com composição de Ti/(RuO2)0,8-(Sb2O3 0,2. Otimizando as variáveis concentração do corante, concentração do eletrólito e densidade de corrente, obteve-se até 100% da remoção de cor e redução de até 76,67% da demanda química de oxigênio em 3h de eletrólise.
Palavras chaves
Oxidação eletroquímica; Otimização de processo; Tratamento de efluente
Introdução
O aumento da demanda de água doce para atender o consumo industrial, humano e agrícola, fez com que surgissem novas estratégias para racionalizar a utilização desse recurso e controlar os impactos causados ao meio ambiente. Concretizando-se como uma meta para as indústrias, os processos que envolvem tecnologias sustentáveis estão sendo cada vez mais exigidos, buscando minimizar ou eliminar as fontes geradoras de resíduos tóxicos (FARRELLY; BROWN, p. 721-732, 2011; SHELDON, p. 1-7, 2016). Em comparação com outras atividades, a indústria têxtil está classificada com um dos índices mais elevados de consumo de água em seus processos. A dificuldade no tratamento dos efluentes oriundos desse tipo de indústria se dá por conta das altas concentrações de carga orgânica não biodegradável, estima-se que a quantidade de corante perdido durante o processo de tingimento seja em torno de 60% (ROSA et al, p. 60-65, 2015). Assim, o caráter não destrutivo dos tratamentos convencionais evidencia graves problemas no setor, estimulando o desenvolvimento de novos métodos capazes de garantir a qualidade do efluente para reuso ou descarte (ALKAYA; DEMIRER, p. 595-603, 2014). Métodos alternativos de tratamentos de efluentes foram se aprimorando à medida que a necessidade fez parte da rotina das indústrias. Algumas técnicas se destacam pela sua alta economia e eficiência (ABIDI et al, p. 432-440, 2015). Os processos oxidativos eletroquímicos avançados (POEA’s) mostraram-se eficazes em diversos tratamentos de efluentes, o grande diferencial desse método está no fato do principal reagente ser o elétron, sendo então classificado como uma alternativa limpa (MARTÍNEZ-HUITLE; BRILLAS, p. 105-145, 2009). A eletroquímica foi considerada por muitos anos uma ciência limitada pela imobilidade dos eletrodos, pois estes eram constituído comumente por carbono. Porém, com avanço tecnológico nesta área, desenvolveu-se o Ânodo dimensionalmente estável (ADE), o qual é constituído por uma haste de metal, normalmente titânio, e recoberto por uma síntese de óxido metálico através de um processo de anodização, é esse recobrimento que vai fornecer ao ADE suas características de cinética e potencial de degradação da matéria orgânica (DEVILLIERS; MAHÉ, p. 8207-8214, 2010; ZERADJANIN et al, p. 408- 414, 2012). Diante da necessidade de conhecer o comportamento do sistema e otimizar as condições em análise para que reduzam as perdas nos processos, o desenvolvimento de modelos é de grande relevância no estudo da degradação de efluentes (KUSIC et al, p.1558-1568, 2011). Entretanto, a aplicação de um sistema eletroquímico em reator tipo batelada utilizando ADE para degradação de corantes têxtis, tendo em vista aplicação no campo industrial, necessitam ser modelados baseados em dados experimentais para ter seus requisitos otimizados e melhorados. Neste contexto, o presente trabalho busca promover a degradação do corante Reativo Preto 5 (RP5) em reator tipo batelada, utilizando processo de eletrólise. O sistema foi modelado e otimizado por técnicas de superfícies de respostas, para prever a remoção de cor e redução da demanda química de oxigênio através de melhores condições de operação associadas ao tempo de reação, concentrações iniciais de corante e eletrólito e da densidade de corrente.
Material e métodos
Preparação e síntese dos eletrodos: Os suportes de titânio, com área de 2 cm², inicialmente foram polidos com lixa de granulação 400, para assim serem tratados com ácido clorídrico (20%) e ácido oxálico (10%), ambos por 10 minutos a 100°C. Os eletrodos foram lavados com água ultrapura e secos a temperatura ambiente, para receber a síntese de recobrimento. A solução precursora foi preparada na concentração de 1 mol L-1 com os sais RuCl3 e SbCl3, os quais foram dissolvidos em 5 mL de hidrogenosulfato metilimidazóico. A síntese foi mantida a 100°C e agitada por um bastão de vidro durante 10 min, após aquecida, a solução foi levada para o ultrassom de ponteira por 10 minutos. A cada aplicação de solução os eletrodos eram levados ao forno para calcinação a temperatura de 550°C, com taxa de aquecimento de 5°C min-1, e após atingir a temperatura final, permaneciam por mais 5 minutos, na calcinação final foi mantido por 1h na temperatura máxima, para então dar início ao resfriamento. O método foi repetido até que os eletrodos obtivessem uma massa de 1,2 g de solução precursora depositada sobre a superfície. Célula eletroquímica: Foi utilizada uma célula eletroquímica de vidro com volume de 100 mL e tampa de Teflon® com quatro orifícios: Um para entrada do gás inerte N2, responsável por retirar o O2 da solução; um para o eletrodo de referência de prata/cloreto de prata (Ag/AgCl); um para o contra eletrodo de platina de área 2 cm2; e um orifício para o eletrodo de trabalho Ti/(RuO2)0,8-(Sb2O3) 0,2 preparado pelo método líquido iônico (hidrogenosulfato metilimidazóico). Eletrólise: Foram adicionados 100 ml de solução contendo o RP5 na célula eletrolítica e cada eletrólise teve uma duração de 3h. Um delineamento experimental 23, com pontos axiais e repetições no ponto central, empregado com método de superfície de resposta (RSM) para analisar a influência das variáveis concentração do corante (26,4 – 93,6 ppm), concentração do eletrólito suporte NaCl (0,0062 – 0,1238 M) e densidade de corrente (1,24 – 24,76 mA cm-2), foram definidas como variáveis dependentes o percentual de remoção do corante, redução da DQO. Remoção de cor: Para determinar a remoção do corante foi realizada a análise de espectroscopia de UV-vis nos tempos: 0, 2, 5, 10, 15 e 30 minutos, utilizando um espectrofotômetro Avantes AvaLight-DHS. Foram utilizadas cubetas de quartzo com caminho óptico de 10 mm. A remoção de cor do RP5 foi observada pela diminuição das absorbâncias lidas em comprimento de onda (λ)=597nm. Redução da DQO: A análise de DQO foi realizada utilizando os parâmetros experimentais da colorimetria do crômio(III) no sistema dicromato/crômio(III) realizados por Zuccari et al (p. 69-82, 2005), nos seguintes tempos: 0, 15, 30, 60, 90, 20, 150, 180 minutos. Utilizando espectrofotômetro Hach-DR5000 sob comprimento de onda (λ)=600nm.
Resultado e discussão
A análise estatística permitiu avaliar a influência das varáveis estudadas
no processo eletroquímico de degradação do corante RP5, ao nível de
confiança de 95%. Pela análise do gráfico de Pareto (Figura 1A), constata-se
que para a resposta remoção de cor, a corrente e concentração do eletrólito
foram as variáveis significativas no processo. A maior corrente aplicada ao
sistema gera maior campo elétrico entre os eletrodos, consequentemente maior
cinética no processo devido a geração das espécies oxidantes (ESSADKI et al
p.1211-1223, 2008). A concentração do corante não foi significativa no
processo frente à contribuição das demais variáveis.
Dentro das faixas analisadas foi possível constatar as condições ótimas do
planejamento experimental. Na Figura 2A, 2B e 2C estão apresentadas as
superfícies de respostas com a combinação das variáveis de entrada do
sistema em função do percentual alcançado de remoção do corante. É possível
constatar o efeito combinado das variáveis independentes e em qual faixa
proporcionaram melhor eficiência na remoção de cor.
Para a variável concentração do eletrólito representadas pelas superfícies
2A e 2C observa-se que a melhor relação de remoção de cor se encontra
próximo ao ponto central. Comportamento similar é observado para a corrente
aplicada representadas pelas superfícies 2B e 2C. Estudos realizados por
Miwa et al (p. 3281-3289, 2006) e Malpass et al (p.2969-2977, 2007) também
demonstram a influência significativa no processo de oxidação eletroquímica
utilizando o NaCl como eletrólito suporte na remoção da cor e mineralização
dos compostos orgânicos quando combinados com uma densidade de corrente. No
entanto, a partir das superfícies 2A e 2B observa-se que a concentração do
corante, não possui efeito significativo para a remoção de cor, como já
constatado na análise de Pareto (Figura 1). Assim, com coeficiente de
correlação (R²) igual a 0,975, a concentração do eletrólito e corrente
obtiveram melhores valores em 0,07 mol L-1 e 13,0 mA
cm-2, respectivamente.
Na Figura 1B é apresentado o gráfico de Pareto para análise da resposta
redução da DQO. A variável concentração do corante demonstra influência
significativa ao processo, uma vez que, uma alta concentração de corante no
efluente faz com que os níveis de carga orgânica aumentem, isso confirma a
importância da corrente na utilização do processo de eletrólise, pois para
que haja a reação eletroquímica é necessário à aplicação de uma corrente
elétrica, neste caso para maior decaimento da DQO fez-se necessário uma
corrente no nível máximo.
Nas superfícies de resposta representadas pela Figura 2C, 2D e 2F são
apresentadas as melhores faixas de aplicações das variáveis para a resposta
DQO, a corrente obteve melhor valor em 20,0 mA cm-2, a
concentração do eletrólito em 0,09 mol L-1 e a concentração do
corante em 30,0 ppm, analisadas com as interações das superfícies. Este
modelo proporcionou uma correlação (R²) igual a 0,916.
O aumento da corrente favorece o consumo de energia no processo de
eletrólise. Uma vez que a concentração do eletrólito está diretamente ligada
a eficiência da corrente, pois as moléculas do eletrólito se dissociam
formando íons que são responsáveis pela condução da corrente elétrica nos
líquidos.
Para verificar a existência de desigualdades significativas sobre as médias
e a influência dos fatores em relação as variáveis dependentes, foi
realizado o estudo das variâncias das variáveis para a resposta remoção de
cor e DQO. Para análise da variação é necessário verificar a regressão
linear e testar o modelo de acordo com a hipótese adotada pelo nível de
significância. A variação explicada (R²) obteve valor de 0,975, isso reflete
uma explicação do modelo de até 97,5% dos dados. O teste F foi utilizado
para verificar a hipótese de rejeitar ou não os valores encontrados, como
Fcalc. (35,75) foi maior que o Ftab. (3,39). Com um
valor pouco mais de 10 vezes maior, o Fcalc. confirma a
correlação do dados e excelente resultado para seguimento das análises.
Logo, pode-se concluir que o valor encontrado foi altamente significativo
para o modelo.
Para a resposta DQO a variação explicada (R²) obteve valor de 0,916, isso
reflete uma explicação do modelo de até 91,6% dos dados, valor pouco menor
do que o obtido para a remoção de cor. O teste F foi utilizado para
verificar a hipótese de rejeitar ou não os valores encontrados, como Fcalc.
(5,68) foi maior que o Ftab. (3,39). Com isso para a reposta DQO
a correlação dos dados também foi qualificada para seguimento das análises.
As equações matemáticas que regem os modelos obtidos pelas superfícies de
respostas para remoção de cor e redução da DQO são representadas pelas
Equações 1 e 2, respectivamente.
RC=98,48+21,83.CE-14,07.CE2+25,76.DC-
14,76.DC2-17,53.CE.DC Eq. 1
DQO=41,10-5,73.CC+5,99.CC2+8,25.CE-17,08.DC Eq.2
onde,
RC representa a remoção de cor (%), DQO representa o decaimento da DQO (%),
CC, CE e DC a concentração do corante, consumo energético e a corrente,
respectivamente, em variáveis codificadas.
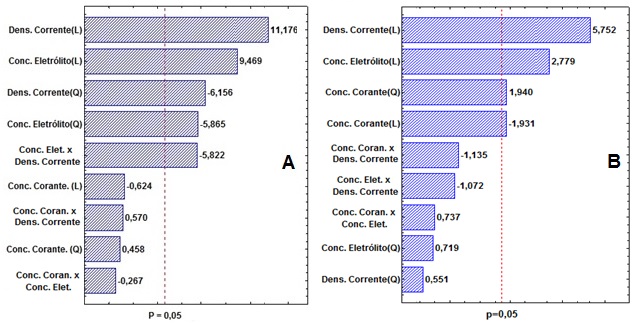
Gráfico de Pareto para variável remoção de cor (A) e para redução da DQO (B), sob nível de significância 5%.
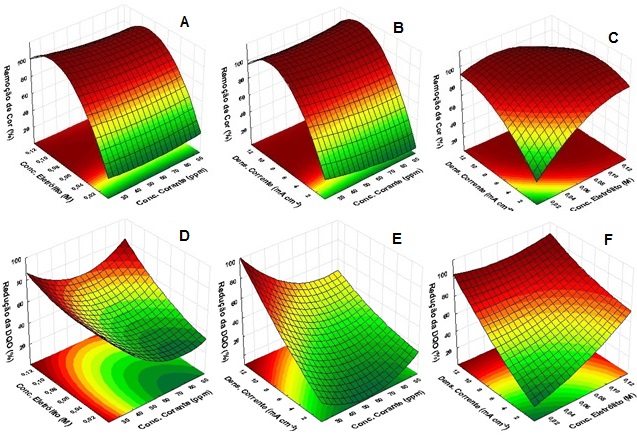
Superfícies de resposta para a variável remoção de cor (A, B e C) e redução da DQO (D, E e F).
Conclusões
Através do processo de degradação eletroquímica com a técnica de eletrólise aplicada ao efluente contendo corante RP5 e utilizando ânodo dimensionalmente estável, obteve-se completa remoção da cor e parcial mineralização da DQO. Técnicas de superfícies de resposta foram utilizadas para modelagem e otimização do processo, na qual foi capaz de predizer 97,5% dos dados para remoção de cor e 91,6% para redução da DQO. O eletrodo preparado por meio de líquido iônico, pode ser considerado eficiente em aplicações para degradação eletroquímica via eletrólise do corante RP5. O aumento das variáveis concentração do eletrólito e corrente favoreciam a remoção de cor e redução da DQO em menor tempo de eletrólise. Estes resultados mostram que o processo pode ser utilizado individualmente ou conjugado a outro com finalidade de tratamento do efluente de indústrias do tipo têxtil para posterior descarte ou reuso do mesmo.
Agradecimentos
Os autores agradecem a Universidade Tiradentes (UNIT) pelo suporte na realização dos experimentos e apoio financeiro.
Referências
ABIDI, N.; ERRAIS, E.; DUPLAY, J.; BEREZ, A.; JRAD, A.; SCAFER, G.; GHAZI, M.; SEMHI, K.; TRABELSI-AYADI, M. Treatment of dye-containing effluent by natural clay. Journal of Cleaner Production, p. 1–9, 2014.
ALKAYA, E.; DEMIRER, G. N. Sustainable textile production: A case study from a woven fabric manufacturing mill in Turkey. Journal of Cleaner Production, v. 65, p. 595–603, 2014.
DEVILLIERS, D.; MAHÉ, E. Modified titanium electrodes: Application to Ti/TiO2/PbO 2 dimensionally stable anodes. Electrochimica Acta, v. 55, n. 27, p. 8207–8214, 2010.
FARRELLY, M.; BROWN, R. Rethinking urban water management: Experimentation as a way forward Global Environmental Change, v. 21, n. 2, p. 721–732, 2011.
KUSIC, H. ; JURETIC, D.; KOPRIVANAC, N.; MARIN, V.; BOZIC, A. L. Photooxidation processes for an azo dye in aqueous media: Modeling of degradation kinetic and ecological parameters evaluation. Journal of Hazardous Materials, v. 185, n. 2-3, p. 1558–1568, 2011.
MALPASS G.R.P., MIWA D.W., MORTARI D.A., MACHADO S.A.S., MOTHEO A.J., Decolorisation of real textile waste using electrochemical techniques: Effect of the chloride concentration, Water Research. v. 41 p. 2969–2977, 2007.
MARTÍNEZ-HUITLE, C. A.; BRILLAS, E. Decontamination of wastewaters containing synthetic organic dyes by electrochemical methods: A general review. Applied Catalysis B: Environmental, v. 87, n. 3-4, p. 105–145, 2009.
MIWA D.W., MALPASS G.R.P., MACHADO S.A.S., MOTHEO A.J., Electrochemical degradation of carbaryl on oxide electrodes, Water Research. v. 40 p. 3281–3289, 2006.
ROSA, J. M.; FILETI, A. M. F.; TAMBOURGI, E. B.; SANTANA, J. C. C. Dyeing of cotton with reactive dyestuffs: The continuous reuse of textile wastewater effluent treated by UV/ H2O2 homogeneous photocatalysis. Journal of Cleaner Production, p. 1–6, 2014.
SHELDON, R. A. Engineering a more sustainable world through catalysis and green chemistry. The Royal Society, v. 1, n. February, p. 1–7, 2016.
ZERADJANIN, A. R.; MANTIA, F. L.; MASA, J.; SCHUHMANN, W. Utilization of the catalyst layer of dimensionally stable anodes—Interplay of morphology and active surface area. Electrochimica Acta, v. 82, p. 408–414, 2012.
ZUCCARI M. L.; GRANER C. A. F.; LEOPOLDO P. R.; Determinação na demanda química de oxigênio (DQO) em águas e efluentes por método colorimétrico alternativo, Energ. Agric. v. 20 p.69-82, 2005.
































