USO DO BIOGLICEROL NA OBTENÇÃO DE HALOIDRINAS E ÉTERES VIA REAÇÕES DE SUBSTITUIÇÃO NUCLEOFÍLICAS EM FASE HETEROGÊNEA.
ISBN 978-85-85905-21-7
Área
Química Verde
Autores
Santos, P.F. (UFRJ-IPPN) ; Pereira, V.L.P. (UFRJ-IPPN)
Resumo
Cerca 10% de bioglicerol é produzido como coproduto da reação de transesterificação de ácidos graxos para a produção de biodiesel, e este vem sendo empregado como matéria-prima para a produção de diversos produtos com alto valor agregado, como as haloidrinas que são úteis intermediários para a síntese de Williamson. O uso de iodetos suportados em sólidos mostrou-se eficiente para a iodação da 1,3-dicloro-2-propanol. Os resultados preliminares permitiram concluir que a SN2 na 1,3-dicloro-2- propanol por iodeto foi mais eficiente em fase heterogênea, havendo formação de 85% da 1,3-diiodo-2-propanol contra 65% em fase homogênea. A mistura de (2) e (3) foi convertida aos diéteres (6) e haloéteres (5), respectivamente, novos derivados etéreos estão sendo investigados.
Palavras chaves
Diiodoidrina de glicerol; KI-Alumina; Síntese de Williamson
Introdução
A produção de biodiesel no Brasil vem crescendo a cada ano, segundo a Agência Nacional do Petróleo (ANP) a produção em dezembro de 2016 foi de 305 mil m³, e com isso há também o aumento de bioglicerol. Cerca 10% de bioglicerol é produzido como coproduto na produção de biodiesel, e por isso se faz necessário processos que visem a conversão desse excedente em produtos de alto valor agregado (MME, 2017; TAN, 2013). Atualmente o bioglicerol vem sendo empregado como matéria-prima na produção de butanol, 1,3-propanodiol, acroleína, haloidrinas, produtos eterificados, e outros produtos (KONG, 2016; BAGNATO, 2017). Dicloroidrina (DCH) e dibromoidrina (DBH) são produzidas comercialmente a partir do propeno (derivado do petróleo), já a diiodoidrina (DIH) pode ser obtida a partir dicloroidrina, por uma reação de substituição nucleofílica bimolecular (SN2). DCH E DBH podem ser provenientes da reação do glicerol com cloreto de hidrogênio gasoso e com solução de ácido bromídrico 48%, respectivamente. O que não ocorre para a DIH, que na presença de ácido iodidrico leva a formação do iodeto isopropilico, através da eliminação de I2. As haloidrinas são úteis intermediários para a síntese de Williamson levando a formação de epóxidos e éteres acíclicos (GLATTFELD, 1933; SINGH, 2013, NASCIMENTO, 2016). Procurando respeitar os princípios estabelecidos pela química verde e contribuir com rotas eficientes para destinação dos excedentes de bioglicerol, o foco deste trabalho visa à síntese da diiodoidrina (3) a partir da dicloroidrina (1) proveniente do bioglicerol, via SN2 utilizando ânions iodeto suportados em sólidos. A reatividade de (3) será investigada, em meio heterogêneo básico, para a produção de éteres- derivados, via síntese de Williamson.
Material e métodos
A metodologia empregada para síntese do intermediário (2) e (3), usando fonte de iodeto suportado em sólido baseou-se nos estudos de EVANGELISTA, 2011. Reagimos 1 mmol da 1,3-dicloro-2-propanol 97,5% (SIGMA-ALDRICH) com KI suportado em óxido de alumínio neutro ou básico (KI-Al2O3) ou com uma resina de troca iônica baseada em iodeto, a uma faixa de temperatura de 0 °C–180 ºC por 1 a 3 dias. Alternativamente, a dicloroidrina foi submetida às condições modificadas de Finkelstein, 1910, em meio homogêneo (NaI em acetona sob refluxo, 4 dias). Para formação dos haloéteres (5) e diéteres (6) via síntese de Williamson, reagiu a mistura de 1,3-cloroiodo-2-propanol (2) e a 1,3-diiodo-2-propanol (3) com uma resina básica na forma hidróxido e álcoois (metílico, etílico e isopropílico), a uma faixa de temperatura de 0 °C – 80 ºC por 1 a 5 h, levando a formação dos mono-éteres e di-éteres. O acompanhamento reacional para avaliar a conversão do(s) substrato(s) ao(s) produto(s) desejado(s) foi realizado em um equipamento de cromatografia gasosa da Shimadzu (CG-2010) com detector de ionização de chama e uma coluna DB-5 (5% fenil-metil-polisiloxano) e usando hidrogênio como gás carreador. A elucidação estrutural realizada por ressonância magnética nuclear (RMN 1H e 13C) em um Varian MR-400 (400 MHz) com TMS de referência interna e com o auxílio de um cromatógrafo gasoso acoplado a massas da Schimadzu (GC/MS-QP 500).
Resultado e discussão
Iniciamos nossos objetivos utilizando KI-Al2O3 (neutra
ou básica), na iodação de (1) na ausência de solvente (esquema 1). Obteve-se
99% de conversão da 1,3-dicloro-2-propanol em 1,3-diiodo-2-propanol (3) e
1,3-cloroiodo-2-propanol (2), no período apresentado. A reação foi também
processada em meio homogêneo utilizando as condições de Finkelstein
modificadas, pois a reação quando submetidas as condições usuais de
Finkelstein houve baixa conversão da 1,3-dicloro-2-propanol nos produtos
desejados. Obteve-se 98% de conversão da 1,3-dicloro-2-propanol em (3) e
(2). Quando a reação se processa em meio heterogênea a formação de (2) e (3)
é pronunciada (figura 2), isto é, nas primeiras 24 h em meio heterogêneo há
conversão de 90% de (1) contra 59% em meio homogêneo. Pode-se notar também
que a presença de (3) no meio reacional foi evidentemente maior em meio
heterogêneo com 85% de formação contra 65% em meio homogêneo, em um menor
período de tempo. Isso evidencia que o meio heterogêneo foi mais efetivo
para a produção do diiodo derivado (3), de nosso interesse. O acompanhamento
reacional foi realizado por CG onde a mistura (2) e (3) apresentaram tempo
de retenção de 5,3 min e 8,1 min, respectivamente e confirmado por RMN-
13C, RMN-1H e CG-EM. Com (2) e (3) em mãos, estudamos
a conversão da mistura aos éteres metilados, etilados e isopropilados,
utilizando uma resina básica na forma hidróxido, esquema 1. As analises de
CG, RMN-13C e 1H após o processamento da reação
mostraram ausência dos sinais referente ao substrato (2) e (3) e formação
dos halo-éteres (5) e dos diéteres (6), respectivamente.
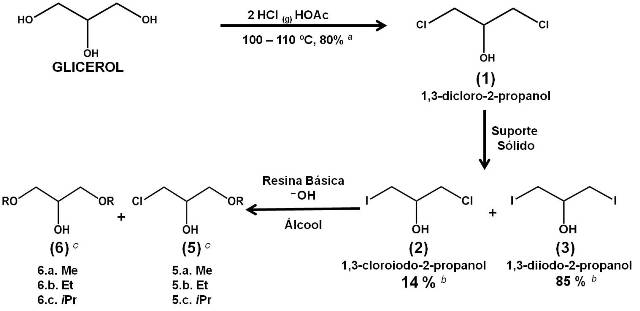
a Rendimento obtido por NASCIMENTO, 2016. b Conversão estimada por cromatografia gasosa. c Conversão proporcional aos substratos correspondentes.
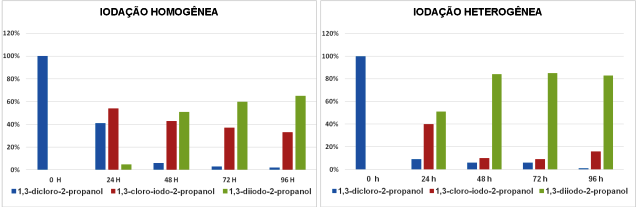
Valores obtidos por cromatografia gasosa
Conclusões
Os resultados preliminares permitiram aferir que a substituição nucleofílica em 1,3-dicloro-2-propanol por iodeto foi mais eficiente em fase heterogênea, havendo formação de 85% da 1,3-diiodo-2-propanol contra 65% em fase homogênea, contribuindo assim com os princípios da química verde. A mistura de (2) e (3) foi convertida aos diéteres e haloéteres, respectivamente, mostrando a pouca habilidade do cloro como grupo de saída. Investigações visando à melhora na conversão de (1) em (3) estão sendo realizadas, assim como a conversão de 1,3- diiodo-2-propanol em novos derivados etéreos.
Agradecimentos
A Deus, a CAPES pelo apoio financeiro e ao grupo de pesquisa LASESB.
Referências
AGÊNCIA UFRJ DE INOVAÇÃO. Fernanda Priscila Carvalho do Nascimento. Processo indireto e conciso para a obtenção da 1,3-diidroxiacetona a partir do glicerol. BR 10 2016 015956 3.
BAGNATO, G.; IULIANELLI, A.; SANNA, A.; BASILE, A. Glycerol Production and Transformation: A Critical Review with Particular Emphasis on Glycerol Reforming Reaction for Producing Hydrogen in Conventional and Membrane Reactors, Italy, v.7, p. 1-31, mar. 2017.
EVANGELISTA, J.P.C. Obtenção de biodiesel através da transesterificação do óleo de farelo de arroz utilizando KI/Al2O3. Natal, UFRN, 2011. 133p.
FINKELSTEIN, H., Darstellung organischer Iodide ausden entsprechenden Bromiden und Chloriden, Strasbourg, p. 1528-1532, mai. 1910.
GLATTFELD, J.W.E.; KLAA, R. The C4-Saccharinic Acids. VI. Further Attempts to Prepare 2,2’-Dihydroxyisobutyric Acid. 2,3-Dihydroxybutyric Acid Lactone from Glycidol. The Preparation of the Two Iodohydrins of Glycerol, Chicago, v. 55, p.1114-1119, mar. 1933.
KONG, P.S.; KHEIREDDINE, M.; MOHD, W.; WAN, A. Conversion of crude and pure glycerol into derivatives : A feasibility evaluation, Malaysia, v. 63, p. 533–555, mai. 2016.
MME. Ministério de Minas e Energia. Boletim Mensal dos Combustíveis Renováveis. Edição Nº 107 de Jan/Fev de 2017.
SINGH, G. S.; MOLLET, K.; D’HOOGHE, M.; DE KIMPE. N. Epihalohydrins in Organic Synthesis, Botswana, v.113, p.1441−1498, dez. 2012.
TAN, H.W. ABDUL AZIZ, A.R.; AROU, M.K. Glycerol production and its applications as a raw material: A review, Malaysia, v.27, p. 118–127, jun. 2013.
































