RASTREAMENTO DA FORMAÇÃO DE RADICAIS LIVRES NO PROCESSO DE OXIDAÇÃO DE BIODIESEL POR RESSONÂNCIA PARAMAGNÉTICA ELETRÔNICA (RPE)
ISBN 978-85-85905-21-7
Área
Química Tecnológica
Autores
Gomes Mantovani, A.C. (UEL) ; Chendynski, L.T. (UEL) ; Salviato, A. (UEL) ; Borsato, D. (UEL) ; Di Mauro, E. (UEL)
Resumo
A técnica spin trapping é considerada uma importante ferramenta no estudo de radicais livres, possuindo uso experimental considerado simples e rápido. A técnica foi aplicada no trabalho para a análise dos radicais livres gerados na degradação de biodiesel. As amostras de biodiesel foram obtidas a partir do processo de transesterificação, por rota metílica, de óleos de milho e soja, e uma amostra comercial. As amostras foram mantidas a 50ºC em estufa e analisadas por RPE no 0, 5⁰, 12⁰ e 20⁰ dia. A partir da análise para indicar o crescimento de spins adultos, foi possível a caracterização das fases da reação radicalar de degradação. O biodiesel comercial apresentou um maior número de spins adultos aprisionados e um maior tempo de reação de degradação, indicando possuir maior estabilidade.
Palavras chaves
spin trapping; radicais livres; RPE
Introdução
Atualmente, os maiores componentes da matriz energética mundial baseiam-se em produtos derivados do petróleo. Produtos como o óleo diesel, gasolina e gás natural, quando usados em massa, têm gerado diversos problemas ambientais. Desse modo, nos últimos anos, a comunidade internacional tem buscado formas alternativas de energia visando a diminuição de poluentes (RAMOS et al., 2013). Dentre as fontes alternativas estudadas destaca-se o biodiesel, considerado por muitos um substituto renovável, limpo e orgânico para o diesel de petróleo (RAMOS et al., 2013). O biodiesel é formado principalmente por ésteres (YAAKOB et al., 2014) produzido a partir do processo de transesterificação de óleos vegetais (KARAVALAKIS E SOTURNAS, 2010), gorduras animais (YAAKOB et al., 2014), graxas residuais (FATTAH et al., 2014), ou pela reciclagem de óleos domésticos (FATTAH et al., 2014). Diversos óleos vegetais podem ser usados para obtenção do biodiesel, como os óleos de: girassol (YAAKOB et al., 2014), soja (YAAKOB et al., 2014), palma (YAAKOB et al., 2014), milho (JAIN E SHARMA, 2012b), mamona (JAIN E SHARMA, 2012b), algodão (JAIN E SHARMA, 2012b), etc. O biodiesel possui baixa estabilidade quando comparado ao diesel de petróleo (YAAKOB et al., 2014). Sua estabilidade pode ser afetada por diversos fatores como temperatura (DE SOUZA et al., 2014), contaminações (YAAKOB et al., 2014), contato com luz (YAAKOB et al., 2014), contato com oxigênio do ar (DE SOUZA et al., 2014). Um dos principais problemas em estudo é quanto a suscetibilidade do biodiesel a processos de oxidação, principalmente quando encontra-se armazenado (KARAVALAKIS E SOTURNAS, 2010). Biodiesel proveniente de óleos e gorduras, naturalmente, está sujeito a auto-oxidação, além de serem afetados pela temperatura, devido a sua formação molecular (JAIN E SHARMA, 2012a). Em relação à oxidação, o biodiesel pode sofrer dois processos: a auto oxidação e, a foto-oxidação. A auto oxidação é o processo mais comum e a maior causa de oxidação no biodiesel, ela ocorre a partir do contato com o oxigênio do ar. O processo baseia-se em uma reação radicalar em cadeia, não reversível, tendo etapas de iniciação, propagação e terminação. Já a foto-oxidação necessita da presença de luz e oxigênio. Nesse processo, a presença de luz UV (Ultravioleta) inicia a decomposição do biodiesel, gerando radicais livres que dão início ao processo de oxidação pela formação de hidroperóxidos (YAAKOB et al., 2014). A Ressonância Paramagnética Eletrônica (RPE) é considerada um dos métodos que apresenta menor ambiguidade na detecção de radicais livres. Mas, os radicais livres de interesse a serem pesquisados nem sempre são possíveis de serem detectados pois suas concentrações podem estar abaixo do limite de detecção do equipamento ou até mesmo devido seu tempo de vida ser muito curto (DUBOSE et al., 1987). Alguns radicais desse tipo são • O2, • OH, radicais alcóxi, entre outros. Assim, o uso do spin trapping tenta superar esses problemas (DUBOSE et al., 1987). A técnica de spin trapping baseia-se na utilização de espécies diamagnéticas para o estudo de sistemas paramagnéticos, como é o caso dos radicais livres com curtos tempos de vida (HARTGERINK, 2012). A espécie diamagnética, spin trapping, é adicionada ao sistema de estudo formando um radical com maior estabilidade, denominado de spin adulto (DAMIAN et al., 2007). O spin adulto pode fornecer pelo menos uma indicação qualitativa da presença de radicais, o tipo de radical livre observado e até mesmo, em alguns casos, informações quantitativas sobre os mesmos (SWARTZ et al., 2007). O spin trapping é considerado uma ferramenta valiosa no estudo de radicais livres pois possui um uso experimental considerado simples, menor demanda de tempo quando comparado com outras técnicas de estudo de radicais livres com curtos tempos de vida (HARTGERINK, 2012), além de permitir a quantificação indireta de radicais (DUBOSE et al., 1987). Essa técnica tem sido aplicada eficientemente na detecção e identificação de vários tipos de radicais livres em amostras in vivo (SWARTZ et al., 2007) assim como em análises de óleos e gorduras (VELASCO et al., 2005), estudos biomédicos (DAVIES, 2013), etc. Levando em consideração a eficiência da técnica para análise de radicais livres, em diferentes áreas, foi aplicada ao estudo dos radicais liberados no processo de degradação de biodiesel, com a tentativa de analisar tal processo através de um método diferente dos convencionais e regulamentados aplicados a esse biocombustível.
Material e métodos
Para a síntese do biodiesel, foram usadas 100 g de óleo de soja e de milho obtidos comercialmente. A reação de transesterificação foi feita utilizando 0,8 g de hidróxido de sódio (F.Maia: 97,0%) como catalisador, por rota metílica, com 50 mL de metanol grau P.A. (ANIDROL®, 99,8%). As misturas foram submetidas à agitação lenta, com aquecimento, sob refluxo a uma temperatura de 65 ºC durante um período de 2 h. Após esse período, as fases foram separadas usando um funil de separação de 500 mL. Para proporcionar a separação de resíduos do catalisador nos ésteres obtidos, o biodiesel formado foi neutralizado com uma solução de ácido clorídrico 0,10% (v/v) a 80 ºC, para evitar a formação de possíveis emulsões. Em seguida, os mesmos foram lavados com água destilada a 80 ºC até que a água de lavagem atingisse o pH neutro, aferido em papel indicador universal pH 1-14 (Macherey Nagel®, Alemanha). Após o processo de neutralização do biodiesel, houve a etapa de desumidificação adicionando-se 8 g de sulfato de sódio anidro PA ACS (Na2SO4 ANIDROL®, 99,0%) no biodiesel formado e neutralizado, visto que o sulfato de sódio foi previamente deixado em estufa a 120 ºC durante 30 min. A mistura foi agitada e em seguida filtrada em papel de filtro quantitativo faixa azul (Quanty®, ~8 µm) a vácuo. As etapas de desumidificação e filtração foram repetidas mais duas vezes. O biodiesel produzido foi armazenado em frasco de vidro sob refrigeração. A amostra de biodiesel comercial (BS-BIOS, Marialva –PR) estava dentro das especificações determinadas por legislação. As amostras de biodiesel produzido, foram submetidas ao aquecimento acelerado até 110 °C de acordo com a norma EN 14112, utilizando-se o equipamento RANCIMAT (marca: METROHM, suíça; modelo: 873). As amostras de biodiesel foram incubadas usando o spin trapping α-Phenyl-N-tert-butylnitrone (PBN) com pureza ≽ 98% comprados da empresa Sigma-Aldrich Chemie GmbH (Steinheim, Alemanha) e usado como recebido. Foram coletadas 1 g de cada amostra de biodiesel e adicionado 1 mg de PBN a cada análise. As amostras foram agitadas manualmente por 2 min até a total solubilização do spin trapping. Após a solubilização, 0,05 g de cada amostra incubada foram pipetadas nos tubos de quartzo de RPE. A metodologia de incubação foi adaptada de VELASCO et al. (2005). Os experimentos de RPE foram realizados em um espectrômetro JEOL (JES-PE-3X) operando em banda X (~9,5 GHz). Os parâmetros adotados foram: centro de campo de 3290 G; varredura de 250 G; tempo de resposta de 0,1 s, frequência de 100 KHz e scan de 4 min. As amostras foram analisadas por RPE imediatamente após o processo de incubação. As amostras de biodiesel foram guardadas em estufa a 50 ºC durante 20 dias. Dados de RPE foram coletados a uma temperatura constante de 70 ºC em intervalos de tempo de 5 min, durante um período de aproximadamente 2 h. Foram coletados dados no 0, 5⁰, 12⁰ e 20⁰ dia. Em todas as medidas foi usado um padrão marcador de campo MgO:Mn2+.
Resultado e discussão
A figura 1 apresenta os espectros de crescimento de radicais das amostras de
biodiesel de milho, soja e comercial. É possível notar que o processo de
degradação do biodiesel de milho ocorreu completamente em 12 dias, enquanto
que o de soja ocorreu em 20 dias, pois os dados obtidos não registraram
sinal
de radicais livres após esse período. O biodiesel comercial apresentou
sinais
de radicais aprisionados até o 20⁰ dia, último dia de análise, sendo que a
etapa de terminação ocorreu após esses 20 dias. Nos espectros é possível
observar as três etapas de degradação oxidativa por mecanismo radicalar das
amostras de biodiesel: a iniciação, propagação e terminação. Na figura 1-c é
observado que o processo de iniciação da reação radicalar inicia-se desde o
primeiro dia de análise (dia 0) e os radicais sendo propagados no 5⁰ dia,
indicando um aumento na captura de radicais livres. A partir do 12⁰ nota-se
um
decaimento na captura desses radicais, apontando a fase de terminação da
reação.
Na figura 1-b é possível notar as fases de iniciação e propagação no
primeiro
dia de análise (dia 0) e, após esse período, a fase de terminação, com queda
na contagem de spins adultos. Na figura 1-a somente foi possível ver as
etapas
de iniciação no primeiro dia de análise (dia 0) e propagação no 5⁰. No 12⁰
dia
a amostra não mais apresentou sinal de radical, indicando que a reação
radicalar tinha terminado, assim, podemos inferir que o processo de
terminação
da reação de degradação dessa amostra ocorreu entre o 5⁰ e 12⁰ dia.
A formação de spins adultos na amostra de biodiesel comercial mostrou-se
superior quando comparado com as outras duas amostras além do processo de
degradação ter se mantido um período de tempo maior. A partir dessas
informações podemos deduzir que os ésteres presentes nessa amostra são mais
estáveis, pois sua fase de propagação radicalar ocorre de forma mais lenta,
concordando com os dados obtidos de estabilidade oxidativa pelo equipamento
Rancimat.
Quanto maior o período de indução, menor a susceptibilidade à degradação
oxidativa. O biodiesel de milho possuiu um período de indução de 0,25 h e o
menor tempo de análises no RPE, o biodiesel de soja, 0,45 h e o comercial,
9,53 h, sendo que essa amostra apresentou maior período de sinais de
radicais
livres no RPE. A partir dessas observações podemos deduzir que, quanto
maior
o período no qual radicais estejam sendo aprisionados, maior é a
estabilidade
da amostra. Quanto menor o tempo de detecção de radicais adultos, indica que
o
biodiesel havia uma menor estabilidade, atingindo a fase de terminação da
reação de modo mais acelerado, levando um menor tempo para sua total
degradação.
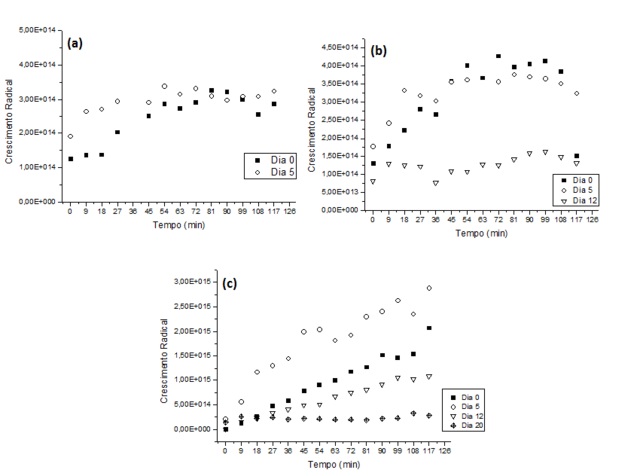
Formação de spins adultos nos biodieseis de (a) milho, (b) soja e (c) comercial.
Conclusões
A partir dos dados foi possível observar as etapas da reação radicalar de degradação das amostras de biodiesel, determinando sua iniciação, propagação e terminação. Observou-se que a amostra comercial apresentou um maior tempo de reação até sua total degradação, indicando ter maior estabilidade, concordando com o respectivo período de indução obtido pela norma EN 14112 (2003).
Agradecimentos
A CAPES pela concessão da bolsa.
Referências
DAMIAN, G.; PETRISOR, D.; MICLAUS, V. Free radicals detection by esr pbn spin-trap technique. Journal of optoelectronics and advanced materials, INOE 2000, v. 9, n. 4, p. 1010–1013, 2007.
DAVIES, K. J. Oxidative damage & repair: Chemical, biological and medical aspects. [S.l.]: Elsevier, 2013.
DUBOSE, C. et al. Spin trapping: Esr parameters of spin adducts. Free radical biology & medicine, v. 5, n. 1, p. 55–56, 1987.
FATTAH, I. R. et al. Experimental investigation of performance and regulated emissions of a diesel engine with calophyllum inophyllum biodiesel blends accompanied by oxidation inhibitors. Energy Conversion and Management, Elsevier, v. 83, p. 232–240, 2014.
HARTGERINK, J. W. Spin trapping by Nitrosoalkanes: Mechanisms of Some Photochemically Induced Reactions. [S.l.]: Springer, 2012.
JAIN, S.; SHARMA, M. Correlation development between the oxidation and thermal stability of biodiesel. Fuel, Elsevier, v. 102, p. 354–358, 2012a.
JAIN, S.; SHARMA, M. Oxidation, thermal, and storage stability studies of jatropha curcas biodiesel. ISRN Renewable Energy, Hindawi Publishing Corporation, v. 2012, 2012b.
KARAVALAKIS, G.; STOURNAS, S. Impact of antioxidant additives on the oxidation stability of diesel/biodiesel blends. Energy & Fuels, ACS Publications, v. 24, n. 6, p. 3682–3686, 2010.
RAMOS, L. P. et al. Biodiesel. Revista Biotecnologia Ciência & Desenvolvimento-Edição nº, v. 31, p. 29, 2003.
SOUSA, L. S. de et al. Use of natural antioxidants in soybean biodiesel. Fuel, Elsevier, v. 134, p. 420–428, 2014.
SWARTZ, H. M.; KHAN, N.; KHRAMTSOV, V. V. Use of electron paramagnetic resonance spectroscopy to evaluate the redox state in vivo. Antioxidants & redox signaling, Mary Ann Liebert, Inc. 2 Madison Avenue Larchmont, NY 10538 USA, v. 9, n. 10, p. 1757–1772, 2007.
VELASCO, J.; ANDERSEN, M. L.; SKIBSTED, L. H. Electron spin resonance spin trapping for analysis of lipid oxidation in oils: inhibiting effect of the spin trap α-phenyl-n-tert-butylnitrone on lipid oxidation. Journal of agricultural and food chemistry, ACS Publications, v. 53, n. 5, p. 1328–1336, 2005.
YAAKOB, Z. et al. A review on the oxidation stability of biodiesel. Renewable and Sustainable Energy Reviews, Elsevier, v. 35, p. 136–153, 2014.
































