SÍNTESE E CARACTERIZAÇÃO POR FTIR DE COLUNAS MONOLÍTICAS MACROPOROSAS FUNCIONALIZADAS PELO MÉTODO DO GLUTARALDEÍDO PARA PURIFICAÇÃO POR AFINIDADE
ISBN 978-85-85905-21-7
Área
Química Tecnológica
Autores
Silva, J.F. (UESB - CAMPUS ITAPETINGA-BA) ; Fontan, R.C.I. (UESB - CAMPUS ITAPETINGA-BA) ; Batista, A.S. (UESB - CAMPUS ITAPETINGA-BA) ; Silva, D.L. (UESB - CAMPUS ITAPETINGA-BA) ; Filho, D.F. (UESB - CAMPUS ITAPETINGA-BA) ; Flores, M.P.S. (UESB - CAMPUS ITAPETINGA-BA) ; Bonomo, R.C.F. (UESB - CAMPUS ITAPETINGA-BA) ; Veloso, C.M. (UESB - CAMPUS ITAPETINGA-BA) ; Nascimento, I.S. (UESB - CAMPUS ITAPETINGA-BA)
Resumo
O desenvolvimento de estruturas monolíticas poliméricas com poros altamente interconectados é constante. Dentre estes, destacam-se os criogéis poliméricos, obtidos a partir do congelamento de uma mistura de monólitos e para melhor utilização dos mesmos, uma alternativa viável é transformá-los em adsorventes de afinidade específica, por meio da enxertia dos mesmos com grupos ligantes de interesse. Os suportes contendo radicais epóxi disponíveis na superfície, estão entre os mais utilizados para a imobilização de biomoléculas, como carboidrato. Sob esse aspecto o presente trabalho teve como objetivo a síntese e caracterização por FTIR de colunas monolíticas macroporosas funcionalizadas pelo método do glutaraldeído, visando a purificação de biomoléculas por afinidade.
Palavras chaves
Criogel; Método do Glutaraldeído; Caracterização
Introdução
Os métodos adsortivos, dentre eles a cromatografia, são utilizadas em pelo menos uma etapa de praticamente todos os processos de purificação de biocompostos existentes, porém, a presença de grandes biomoléculas e materiais muito concentrados desafiam os limites dos métodos cromatográficos tradicionais. Para superar esses inconvenientes, vem ocorrendo o desenvolvimento das colunas monolíticas poliméricas supermacroporosas, que permitem a separação de grandes biomoléculas e até mesmo de células inteiras em materiais não clarificados. Por essa razão a otimização dessas técnicas é de grande relevância, por trazer impacto direto no rendimento de tais processos (STICKEL e FOTOPOULOS, 2001FONTAN, 2013). Dentre os monólitos utilizados como colunas cromatográficas, os criogéis poliméricos vêm apresentando destaque. Estes possuem elevada porosidade, com grandes poros interconectados, apresentando baixa resistência ao escoamento, permitindo o uso de soluções mais viscosas, além de serem mais econômicos que as colunas tradicionais. Em contrapartida, a área superficial dessas colunas é menor do que as tradicionais colunas cromatográficas, possuindo uma menor capacidade de ligação, o que acaba diminuindo a eficiência da purificação. Para contornar esse problema, surge a necessidade de modificar quimicamente ou fisicamente tais colunas KUMAR et al., 2006; YAO et al., 2007), visando aperfeiçoar o processo de utilização dos leitos monolíticos como suporte para imobilização e purificação de biomoléculas (MALLIK; HAGE, 2006). Posto que exista uma ampla variedade de suportes monolíticos que se encontram à disposição para fins de purificação das mais diversas biomoléculas existentes, não há um que seja uma solução universal. Os suportes contendo radicais epóxi disponíveis na superfície estão entre os mais utilizados para a imobilização de biomoléculas. Isso ocorre em razão de tais grupos poderem reagir facilmente com grupamentos amina, tiol ou hidroxila das moléculas, formando uma interação covalente estável (MATEO et al., 2000; MATEO et al., 2003). Dentre os métodos que utilizam como suporte uma matriz macroporosa contendo radicais epóxi reativo, destaca-se nesse trabalho o método do glutaraldeído, que apresenta como vantagem principal a capacidade de formação de um longo braço espaçador entre o criogel e o ligante, evitando possíveis efeitos de impedimento estérico o que pode acarretar em uma maior capacidade de imobilização do ligante e de purificação da molécula alvo (PETRO; SVEC; FRÉCHET, 1996; LUO et al., 2002; MALLIK; HAGE, 2006). Nesse contexto, o grupo ligante que será adicionado ao criogel no presente estudo será o carboidrato, devido à habilidade das lectinas se ligarem a esses compostos, o que favorecerá a adsorção na coluna aumentando assim a eficiência no processo de purificação. (KUMAR et al., 2006; YUN et al.,2009; WANG et al., 1998). Outro fator importante é a caracterização desses materiais, visando conhecer as suas propriedades e assim propiciar maior eficiência e rendimentos nos processos de purificação. Assim, os grupos funcionais podem exercer influência nas propriedades dos criogéis supermacroporosos, sendo assim, a análise da espectroscopia FTIR é utilizada, uma vez que, todas as substâncias moleculares orgânicas e inorgânicas absorvem radiação na região do infravermelho e essa análise traz informações sobre a presença de grupos funcionais e intensidade de transmitância nos criogéis. (GOMES, 1986). Sob esse aspecto o presente trabalho teve como objetivo a síntese e caracterização por FTIR de colunas monolíticas macroporosas funcionalizadas pelo método do glutaraldeído visando a purificação de biomoléculas por afinidade.
Material e métodos
SINTESE DOS CRIOGÉIS: Para a síntese dos criogéis, foram adaptadas as metodologias propostas por Kumar et al. (2006) e Yao et al. (2006). Foi preparado em banho de gelo, 100mL de solução contendo 6% de monômeros totais, com 3,92g de AAm, 1,2g de BAAm e 0,88g de AGE. Em seguida foram adicionados então, 120µL de solução de persulfato de amônio com 0,5 g/mL (APS) e 78 µL de N,N,N,N-tetrametiletilenodiamino (TEMED). A solução foi homogeneizada e logo após foi vertida em seringas plásticas de 5 mL e imersas em um banho termostático a temperatura de -20°C por 24 h. Decorrido esse tempo, as seringas foram mantidas a temperatura de 4°C por 4 h para o descongelamento da água existente e levadas para estufa com circulação de ar forçada a uma temperatura de 60°C. Após a secagem completa, cada criogel foi submetido ao corte das extremidades defeituosas e lavado com cerca de 170 mL de água destilada, utilizando-se uma bomba peristáltica a 6 rpm, e novamente secados em estufa para posterior utilização no processo de imobilização dos carboidratos. MÉTODO DO GLUTARALDEÍDO: O carboidrato utilizado no presente trabalho foi a D-GlcNAc e para a sua imobilização pelo método do glutaraldeído foi utilizada metodologia adaptada de Gonçalves et al. (2016). Inicialmente, os criogéis foram pesados e colocados em contato com 20 mL de álcool etílico absoluto por 2 horas. Posteriormente foram lavados com 20 mL de água destilada, seguido de lavagem com tampão carbonato 0,05M pH 9,5 (20 mL), ambos com tempo de contato de 1 hora. Em seguida, os mesmos foram imersos em 20 mL de etilenodiamina 0,5 M em tampão carbonato e mantidos sob agitação por 14 horas à temperatura ambiente. Após essa etapa os criogéis foram lavados com água destilada e depois tampão fosfato de sódio 0,1 M pH 7,2, cada etapa com 1 hora de duração. Então, os criogéis foram postos em contato com 20 mL de solução de glutaraldeído a 5% m/v em tampão fosfato, à temperatura controlada, por 5 horas e logo após lavados duas vezes com água destilada por 30 minutos, para remoção do excesso de glutaraldeído. Na sequência os criogéis aldeído-ativados foram postos em contato com solução de D-GlcNAc concentrações, preparadas em tampão fosfato de sódio, durante 17 horas à temperatura ambiente. Feito isso, as colunas foram imersas em 20 mL de solução de borohidreto de sódio 0,1 M em tampão carbonato, por 30 minutos e lavados com 20 mL de água destilada, seguido de 20 mL de etanolamina 0,1 M no tampão carbonato e novamente 20 mL de água destilada, as três últimas etapas com 1 hora de duração cada. Após a ativação os criogéis foram secos em estufa a 60°C. ESPECTROSCOPIA DE INFRAVERMELHO POR TRANSFORMADA DE FOURRIER: As amostras de criogéis antes e após a imobilização foram desidratadas, transformadas em pó e lidas diretamente utilizando-se e técnica de reflectância total atenuada (ATR) na região infravermelha de 4000-500. cm-1 em um espectrofotômetro FTIR.
Resultado e discussão
O processo de criogeleificação da mistura de poliacrilamida resultou em
criogéis de estrutura esponjosa, coloração esbranquiçada, forma cilíndrica,
uniforme e rígida quando desidratados. Por se tratar de uma estrutura
altamente porosa, quando hidratados apresentaram estrutura macia e elástica,
como pode ser observado na Figura 1 (PERSSON et al., 2004; ARVIDSSON et al.,
2002; YAO et al., 2006).
E relação à imobilização da D-GlcNAc pelo método do glutaraldeído a
quantidade imobilizada foi de 70,48mg de açúcar por grama de criogel seco,
valor este menor do que o encontrado por Gonçalves et al. (2016) trabalhando
também com criogel de poliacrilamida e o carboidrato D-GlcNAc. Para melhor
avaliar esse processo, foi realizado análise de espectroscopia por FTIR onde
foi possível avaliar os grupos funcionais existentes no criogel antes e após
a imobilização, como pode ser observado na Figura 2.
Inicialmente é possível observar no espectro que representa o
criogel não ativado a presença de uma banda com transmitância acentuada na
região de 1651,3cm-1 e esta vibração formada é característica do grupamento
amida, proveniente dos monômeros (AAm e BAAm) utilizados na síntese do
criogel. Coates (2000), Perçin et al. (2015) e Gonçalves et al. (2016),
trabalhando com criogéis de poliacrilamida, identificaram nos espectros de
FTIR a ocorrência de bandas fortes em torno desse comprimento de onda,
indicando que essa banda representa a amida. Outra característica notável é
em torno da região de 1118,3cm-1 que indica o estiramento do grupo C-O
devido à presença dos radicais epóxi provenientes do AGE, agente iniciador
dos braços espaçadores, na qual o carboidrato vai se fixar no fim da
imobilização (ALCÂNTARA, 2013).
Em relação aos criogéis que passaram pela imobilização pelo método
do glutaraldeído, também na Figura 2 observa-se que o criogel ativado
apresentou uma redução considerável na intensidade das bandas em toda a
faixa avaliada e consideravelmente nas bandas de 1651,3 cm-1 e 1118,44 cm-1,
características do grupamento amida e C-O respectivamente. Essa redução na
intensidade das bandas, em relação ao criogel não ativado não indica
necessariamente que o processo de imobilização não tenha sido eficiente,
pode se dever à interação dos grupos já presentes na superfície do criogel
com as moléculas advindas dos demais compostos que foram introduzidos no
decorrer da imobilização pelo método do glutaraldeído. Por exemplo, a
redução da banda 1118,44 cm-1 características dos radicais epóxi, pode ser
explicada devido ao fato deste ser o agente iniciador dos braços espaçadores
e por isso, no decorrer da imobilização a sua disponibilidade é reduzida,
uma vez que, outros componente se ligam a este (PERÇIN et al., 2015).
Outras bandas ainda podem ser observadas em ambos os espectros, como
a vibração formada no comprimento de onda 3186,3 cm-1 representando também o
grupo amida, a banda 2927 cm-1 indicativo do estiramento assimétrico do
grupo CH2, 1447 cm-1 flexão assimétrica e 1312 cm-1 flexão simétrica deste
mesmo grupo funcional. Esse mesmos grupos foram encontrados por Coli (2013)
avaliando espectros de matrizes de hidrogéis de N-isopropilacrilamida
(NIPAAm).
Criogel puro produzido com 0,88% AGE. À esquerda o criogel seco e à direita hidratado, onde percebe-se o inchamento do mesmo devido à alta porosidade.
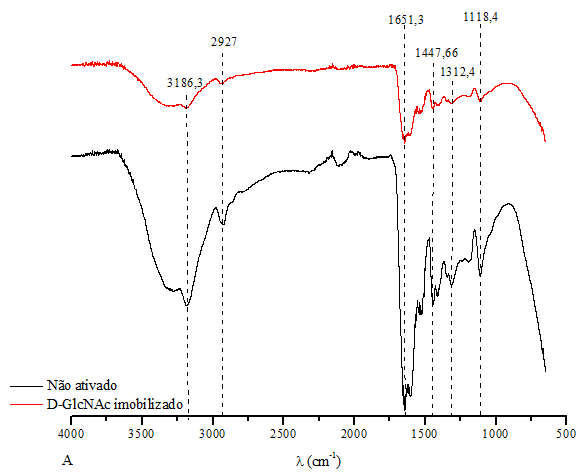
Espectros de FTIR dos criogéis não ativados e após a imobilização do açúcar pelo método do glutaraldeído.
Conclusões
No presente trabalho foram produzidos criogéis macroporosos contendo radicais epóxi, que são utilizados como iniciadores dos braços espaçadores durante a imobilização de carboidrato. A imobilização de D-GlcNAc na superfície dos criogéis testados pelo método do glutaraldeído foi realizada e o resultado confirmado por meio da análise quantitativa do carboidrato imobilizado e avaliação por meio do FTIR. A avaliação dos espectros obtidos por meio do FTIR demostrou que os grupos funcionais encontrados são característicos dos componentes utilizados na síntese da matriz monolítica, no entanto quando comparados aos criogéis ativados, houve redução na intensidade das bandas em toda a faixa avaliada. Diante do exposto faz-se necessário a continuidade dos estudos a fim de se encontrar uma condição onde se consiga ampliar quantidade de açúcar imobilizado. Ainda nesse contexto, uma melhor avaliação dos resultados da espectroscopia para melhor estudar esse efeito da redução das bandas nos espectros dos criogéis funcionalizados, ou a combinação do FTIR com o FT RAMAN.
Agradecimentos
Referências
ALCÂNTARA, A. P. Imobilização de lipase em criogel supermacroporosos para síntese de lipídios estruturados. 92f. Tese (Doutorado em Ciência e Tecnologia de Alimentos). Departamento de Tecnologia de Alimentos, Universidade Federal de Viçosa, Viçosa-MG, 2013.
ARVIDSSON, P.; PLIEVA, F. M.; SAVINA, I. N.; LOZINSKY, V. I. ; FEXBY, S.; BÜLOW, L.; GALAEV, I. Y. ; MATTIASSON, B. Chromatography of microbial cells using continuous supermacroporous affinity and ion-exchange columns. Journal of Chromatography A, v.977, 27-38, 2002.
COATES, J. Interpretation of Infrared Spectra, A Practical Approach. Encyclopedia of Analytical Chemistry. R. A. Meyers (Ed.) p. 10815–10837. John Wiley & Sons Ltd, Chichester, 2000.
COLI, M. Síntese e Caracterização de Nanopartículas de Prata em Matrizes de Hidrogéis Eletro-termossensíveis. 101p. Dissertação (Mestrado em Ciências em Materiais para Engenharia). Itajubá, 2013.
FONTAN, R. C. I. Desenvolvimento e caracterização de trocador catiônico supermacroporoso para a purificação de macromoléculas. 147 p. Tese (Doutorado em Ciência e Tecnologia de Alimentos). Departamento de Tecnologia de Alimentos, Universidade Federal de Viçosa, Viçosa-MG, 2013.
GOMES, C. F. Argilas: o que são e para que servem. Lisboa: Fundação Calouste Gulbenkian, p. 7-16, 24, 25, 96, 186, 271, 374, 1986.
GONÇALVES, R. F. G; GANDOLFI, O. R. R.; SANTOS; M. S. S.; BONOMO, R. C. F.; VELOSO, C. M.; FONTAN; R. C. Development of supermacroporous monolithic adsorbents forpurifying lectins by affinity with sugars. Journal of Chromatography B, v.1033-1034, n. 406-412, 2016.
KUMAR, A.; BANSAL, V.; ANDERSSON, J.; ROYCHOUDHURY, P. K.; MATTIASSON, B. Supermacroporous cryogel matrix for integrated protein isolation. immobilized metal affinity chromatographic purification of urokinase from cell broth of a human kidney cell line. Journal of Chromatography A, v.1103, n.1, p.35-42, 2006.
LUO, Q.; ZOU, H.; ZHANG, Q.; XIAO, X.; NI, J. High-performance affinity chromatography with immobilization of protein A and L-histidine on molded monolith, Biotechnology and Bioengineering, Vol. 80, n. 5, p. 481-489, 2002.
MATEO, C.; ABIAN, O.; FERNANDEZ–LAFUENTE, R.; GUISAN, J. M. Increase in conformational stability of enzymes immobilized on epoxy-activated supports by favoring additional multipoint covalent attachment, Enzyme and Microbial Technology, Vol. 26, n. 7, p. 509-515, 2000.
MATEO, C.; TORRES, R.; FERNÁNDEZ-LORENTE, G.; ORTIZ, C. Epoxy Amino Groups: A New Tool for Improved Immobilization of Proteins by the Epoxy Method, Biomacromolecules, Vol. 4, n. 3, p. 772-777, 2003.
PERÇIN, I.; KHALAF, R.; BRAND, B.; MORBIDELLI, M.; GEZICI, O. Strong cation-exchange chromatography of proteins on a sulfoalkylated monolithic. Journal of Chromatography A, v. 1386, p. 13–21, 2015.
PERSSON, P., BAYBAK, O., PLIEVA, F.M., GALAEV, I.Y., MATTIASSON, B., NILSSON, B., AXELSSON, A. Characterization of a continuous supermacroporous monolithic matrix for chromatographic separation of large bioparticles. Biotechnology and Bioengineering 88, 224, 2004.
PETRO, M.; SVEC, F.; RÉCHET, J. M. J. Immobilization of trypsin onto “molded” macroporous poly(glycidyl methacrylate-co-ethylene dimethacrylate) rods and use of the conjugates as bioreactors and for affinity chromatography. Biotechnology and Bioengineering, v. 49, n. 4, p. 355-363, 1996.
STICKEL, J. J.; FOTOPOULOS, A. Pressure-Flow Relationships for Packed Beds of Compressible Chromatography Media at Laboratory and Production Scale. Biotechnology Progress, v.17, n.4, p.744-751, 2001.
YAO, K.; YUN, J.; SHEN, S.; CHEN, F. In-situ graft-polymerization preparation of cation-exchange supermacroporous cryogel with sulfo groups in glass columns. Journal of Chromatography A, v.1157, n.1-2, p.246-251, 2007.
YAO, K.; SHEN, S.; YUN, J.; WANG, L.; HE, X.; YU, X. Preparation of polyacrylamide-based supermacroporous monolithic cryogel beds under freezing-temperature variation conditions. Chemical Engineering Science, v.61, n.20, p.6701-6708, 2006.
































