Aplicação de diferentes métodos de secagem e avaliação do perfil dos ácidos graxos presentes na biomassa de microalgas
ISBN 978-85-85905-21-7
Área
Química Tecnológica
Autores
Fornasier, F. (UNISC) ; Souza, M.P. (UNISC) ; Schneider, R.C.S. (UNISC) ; Benitez, L.B. (UNISC) ; Hoeltz, M. (UNISC)
Resumo
A separação de microalgas ainda é um desafio, uma vez que apresentam baixas densidades e são encontradas em suspensão no meio de cultura. A secagem é uma etapa importante do processo de obtenção da biomassa e pode influenciar na qualidade do produto final. O presente trabalho teve como objetivo avaliar diferentes métodos de secagem, por estufa, liofilização e spray dryer, e verificar a qualidade da biomassa microalgal em relação ao perfil de ácidos graxos. A composição de ácidos graxos foi determinada por Espectrometria de Massa de Cromatografia de Gás (Shimadzu / QP2010plus). Os resultados indicaram que os três métodos de secagem aplicados foram satisfatórios e não apresentaram diferença quanto a composição lipídica.
Palavras chaves
MICROALGAS; SECAGEM; ÁCIDOS GRAXOS
Introdução
As microalgas são micro-organismos que se adaptam facilmente com as condições ambientais, pois sua estrutura celular é consideravelmente simples. Devido a sua elevada taxa de crescimento, possuem também uma alta produtividade de lipídios, uma vez que seus metabólitos são alterados para a acumulação natural de triacilgliceróis [1]. Quando os fatores químicos e físicos do meio de cultura são alterados, possuem a capacidade de produzir lipídios específicos [2-6]. Através da fotossíntese e de fontes de carbono como o CO2, é possível sintetizar diferentes ácidos graxos. Dentre os principais ácidos graxos presentes na biomassa de microalgas estão o ácido oleico e o linoleico [7-9]. Para se obter a biomassa, é necessário separá-la, e em seguida realizar a secagem [9]. Assim, para a obtenção dos lipídios, a secagem é uma etapa importante do processo. Embora possa consumir elevadas quantidades de energia, proporciona uma melhor extração dos lipídios na etapa seguinte [10]. Diversos métodos de secagem podem ser encontrados na literatura, como por exemplo, liofilização, secagem em tambor, estufa e spray dryer [11-13]. A escolha destes deve ser bastante estudada uma vez que o uso de temperaturas maiores que 50 °C podem degradar componentes celulares importantes das microalgas. Isso ocorre, por exemplo com a secagem por estufa, que por utilizar aquecimento por maior tempo, pode modificar as propriedades físicas e químicas da célula, principalmente a capacidade de reter lipídio, o que interfere na qualidade do produto final. Já o método de secagem por liofilização garante maior estabilidade quando relacionado aos lipídios produzidos, mas também pode romper as células e desestabilizar os lipídios durante o congelamento. [14, 15]
Material e métodos
A espécie de microalga Chlorella vulgaris, foi cultivada em fotobiorreatores do tipo coluna de bolhas. Dois cultivos foram realizados, por um período de 12 dias cada, sendo controlados, temperatura (25 °C), iluminação (lâmpadas de 32W), aporte de CO2 e meio de crescimento. Inicialmente a microalga se desenvolveu em um meio contendo 3 g L-1 de N:P:K e após o meio foi alimentado com 6 g L -1 de N:P:K. O crescimento da microalga foi acompanhada através da contagem de células por câmara de Newbauer e a partir da densidade celular determinada por espectrofotometria a 682 nm. A secagem por spray dryer foi realizada com fluxo de N2, as temperaturas de entrada utilizadas foram de 110 °C e 170 °C. Para a secagem por estufa e liofilização, a biomassa foi separada previamente por centrifugação. A biomassa úmida foi disposta em placas de petry e secas a uma temperatura de 50 °C por 24 horas (estufa) e á – 50 °C, sob vácuo de 1x10-6 mBAR, por 20 horas (liofilização). Todas as secagens das biomassas foram realizadas a partir de 1 L de inóculo. As extrações lipídicas das biomassas secas foram realizadas através do método descrito por Bligh e Dyer. A análise quantitativa dos lipídios extraídos, foi realizada por cromatografia gasosa com detecção por espectrometria de massas (CG-MS) em um equipamento Shimadzu ® QP 2010 Plus equipado com Injetor Automático AOC 20i, sendo as amostras separadas em uma coluna capilar Zbwax (30 m x 0,25 mm x 0,25 µm). O gás hélio foi utilizado como gás de arraste e a sua taxa de fluxo foi de 1 mL min-1. A programação de temperatura do forno foi 70°C até 250 °C, totalizando 49,5 minutos de análise. Temperatura do detector 300 °C, operado no modo “split” 1:10 e volume de injeção de 1 μL.
Resultado e discussão
A máxima densidade celular obtida no inóculo alimentado com 3 g L
-1 de N:P:K foi de 1,22×107 cel/mL. Ao alterar a
concentração de N:P:K para 6 g L-1, foi possível obter a
concentração máxima de células de 1,63×107 cel/mL.
Baierle, et al. [16], ao cultivar a espécie Desmodesmus subspicatus,
observaram que em 7 dias de cultivo, foi possível obter maior densidade
celular (1,84×107 cel/mL), quando comparado com a espécie
Chorella vulgaris.
O conteúdo lipídico das amostras, foi caracterizado por GC-MS. A tabela
apresenta os resultados obtidos. Para a espécie Chlorella, é comum encontrar
ésteres metílicos que contenham de 14 a 18 carbonos na cadeia, dentre eles
os ácidos palmítico, oleico e o linoleico [7-9]. Outra espécie de microalga,
T. suecica, também possui em sua composição ésteres metílicos similares ao
da espécie Chlorella [17].
Observa-se que o éster metílico do ácido palmítico (C16:0), saturado,
predomina nas amostras, ocorrendo o mesmo em espécies como Spirulina e
Nannochloropsis [18]. Outros ésteres metílicos saturados, podem ser
encontrados nas amostras como o ácido mirístico (C14:0) e o ácido esteárico
(C18:0), assim como os ésteres insaturados oleico (C18:1), linoleico (C18:2)
e linolênico (C18:3) [19, 20].
Nas análises cromatográficas, o total de ésteres metílicos insaturados em
todas as amostras foi maior que o teor de saturados, não observando-se uma
diferença devido a processos de secagem, a não ser para uma amostra seca em
estufa na qual o teor de ácidos graxos insaturados foi menor. Quando se
emprega o spray dryer, pelo aquecimento ser em curto espaço de tempo, não
leva a degradação das insaturações de forma visível, assim como para os
demais métodos de secagem avaliados.
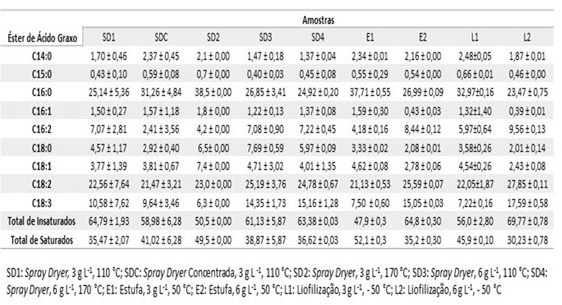
Tabela com Perfil de Ésteres Metílicos dos Ácidos Graxos, obtidos a partir da análise cromatográfica dos lipídios extraídos da biomassa de microalgas.
Conclusões
A predominância dos mesmos ácidos graxos foi encontrada em todas as amostras. A técnica de secagem por liofilização mostrou-se eficiente na conservação dos ácidos graxos, principalmente para o linolênico (C18:3). Já para as técnicas de secagem por estufa e spray dryer, os ácidos graxos palmítico (C16:0) e linoleico (C18:2), foram predominantes. Os métodos de secagem mostraram-se adequados, no entanto, o método de secagem spray dryer pode evitar etapas anteriores de centrifugação. Porém é necessário considerar que elementos do meio de cultura podem ser concentrados junto à biomassa.
Agradecimentos
Os autores agradecem a Fapergs, pelo apoio financeiro, à UNISC e ao Centro de Excelência em Produtos e Processos Oleoquimicos e Biotecnológicos do Parque Científico e
Referências
[1] A.E.-F. Abomohra, W. Jin, R. Tu, S.-F. Han, M. Eid, H. Eladel, Microalgal biomass production as a sustainable feedstock for biodiesel: Current status and perspectives, Renewable and Sustainable Energy Reviews 64 (2016) 596-606.
[2] E.M. Radmann, J.A.V. Costa, Conteúdo lipídico e composição de ácidos graxos de microalgas expostas aos gases CO2, SO 2 e NO, (2008).
[3] T.M. Mata, A.A. Martins, N.S. Caetano, Microalgae for biodiesel production and other applications: A review, Renewable and Sustainable Energy Reviews 14(1) (2010) 217-232.
[4] G.S. Araujo, L.J.B.L. Matos, J.O. Fernandes, S.J.M. Cartaxo, L.R.B. Gonçalves, F.A.N. Fernandes, W.R.L. Farias, Extraction of lipids from microalgae by ultrasound application: Prospection of the optimal extraction method, Ultrasonics Sonochemistry 20(1) (2013) 95-98.
[5] X. Bai, P.M. Schenk, Z. Yuan, P.A. Lant, S. Pratt, Enhanced triacylglyceride extraction from microalgae using free nitrous acid pre-treatment, Applied Energy 154 (2015) 183-189.
[6] Q. Hu, M. Sommerfeld, E. Jarvis, M. Ghirardi, M. Posewitz, M. Seibert, A. Darzins, Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances, The Plant Journal 54(4) (2008) 621-639.
[7] J.-Y. Lee, C. Yoo, S.-Y. Jun, C.-Y. Ahn, H.-M. Oh, Comparison of several methods for effective lipid extraction from microalgae, Bioresource Technology 101(1, Supplement) (2010) S75-S77.
[8] P.K. Campbell, T. Beer, D. Batten, Life cycle assessment of biodiesel production from microalgae in ponds, Bioresource Technology 102(1) (2011) 50-56.
[9] E.A. Mahmoud, L.A. Farahat, Z.K. Abdel Aziz, N.A. Fatthallah, R.A. Salah El Din, Evaluation of the potential for some isolated microalgae to produce biodiesel, Egyptian Journal of Petroleum 24(1) (2015) 97-101.
[10] C.-L. Chen, C.-C. Huang, K.-C. Ho, P.-X. Hsiao, M.-S. Wu, J.-S. Chang, Biodiesel production from wet microalgae feedstock using sequential wet extraction/transesterification and direct transesterification processes, Bioresource Technology 194 (2015) 179-186.
[11] H. Desmorieux, J. Madiouli, C. Herraud, H. Mouaziz, Effects of size and form of Arthrospira Spirulina biomass on the shrinkage and porosity during drying, Journal of Food Engineering 100(4) (2010) 585-595.
[12] A.P. Florentino de Souza Silva, M.C. Costa, A. Colzi Lopes, E. Fares Abdala Neto, R. Carrhá Leitão, C.R. Mota, A. Bezerra dos Santos, Comparison of pretreatment methods for total lipids extraction from mixed microalgae, Renewable Energy 63 (2014) 762-766.
[13] A. Guldhe, B. Singh, I. Rawat, K. Ramluckan, F. Bux, Efficacy of drying and cell disruption techniques on lipid recovery from microalgae for biodiesel production, Fuel 128 (2014) 46-52.
[14] L. Bennamoun, M.T. Afzal, A. Léonard, Drying of alga as a source of bioenergy feedstock and food supplement – A review, Renewable and Sustainable Energy Reviews 50 (2015) 1203-1212.
[15] C.-L. Chen, J.-S. Chang, D.-J. Lee, Dewatering and Drying Methods for Microalgae, Drying Technology 33(4) (2015) 443-454.
[16] F. Baierle, D.K. John, M.P. Souza, T.R. Bjerk, M.S.A. Moraes, M. Hoeltz, A.L.B. Rohlfes, M.E. Camargo, V.A. Corbellini, R.C.S. Schneider, Biomass from microalgae separation by electroflotation with iron and aluminum spiral electrodes, Chemical Engineering Journal 267 (2015) 274-281.
[17] M.A. Chia, A.T. Lombardi, M.d.G.G. Melão, C.C. Parrish, Lipid composition of Chlorella vulgaris (Trebouxiophyceae) as a function of different cadmium and phosphate concentrations, Aquatic Toxicology 128–129 (2013) 171-182.
[18] A. Patel, B. Gami, P. Patel, B. Patel, Microalgae: Antiquity to era of integrated technology, Renewable and Sustainable Energy Reviews 71 (2017) 535-547.
[19] P.L. Gupta, H.-J. Choi, R.R. Pawar, S.P. Jung, S.-M. Lee, Enhanced biomass production through optimization of carbon source and utilization of wastewater as a nutrient source, Journal of Environmental Management 184 (2016) 585-595.
[20] J. Huang, J. Xia, W. Jiang, Y. Li, J. Li, Biodiesel production from microalgae oil catalyzed by a recombinant lipase, Bioresource Technology 180 (2015) 47-53.
































