INTERAÇÃO POR DOCAGEM MOLECULAR DO COMPLEXO DI-L-CLORO-BIS [CLORO (4,7-DIMETIL-1, 10-FENANTROLINA) CÁDMIO (II)] COM MICROORGANISMOS BACTERIANOS
ISBN 978-85-85905-23-1
Área
Bioquímica e Biotecnologia
Autores
Bastos, R.S. (UFMA) ; Araujo, J.L. (UFMA) ; Rocha, J.A. (UFMA)
Resumo
A Staphylococus aureus e a Escherichia coli são bactérias causadoras de várias doenças infecciosas. O processo de docagem interagiu o ligante dimérico di-l- cloro-bis [cloro (4,7-dimetil-1, 10-fenantrolina) cádmio (II)] com ambas as bactérias com o objetivo de estudar suas interações moleculares, através do software computacional 1.5.6. Por meio do mesmo foi possível analisar as constantes de interação e suas energias de ligação, assim como o não surgimento de pontes de hidrogênio, dando ênfase na melhor interação da S. aureus com o ligante estudado.
Palavras chaves
S. aureus; E. Coli; Docagem molecular
Introdução
A Staphylococus aureus é uma bactéria pequena e muito resistente que tem como seu habitat a membrana mucosa da pele, atingindo também faringe, trato gastrointestinal, tanto de animais quanto de humanos, sua forma de contração mais comum são infecções na epiderme, provocando espinhas, furúnculos e síndrome de pele. É uma doença com potencial de mortalidade, podendo ser transmitida por cães, gatos e cavalos (BAGNOLI; RAPPUOLI; GRANDI, 2018; BATABYAL, 2017; FETSCH, 2017). A Escherichia coli é uma das mais antigas bactérias simbiontes do homem, um comensal humano, presente no trato digestivo, sua colonização acontece logo no nascimento, sendo derivado da mãe, mas podendo ser encontrada também no meio ambiente contaminado por dejetos fecais, além disso serve, para muitos animais, como uma fonte de vitaminas (SUSSMAN, 1997). Em sua maioria, com algumas exceções, não fornecem riscos, entretanto as demais, causam infecções urinárias, doenças diarréicas que provocam uma taxa grande de mortalidade infantil (BERG, 2008; CLERMONT, 2000). O processo de docagem molecular consiste na interação de um receptor e um ligante, fazendo uma configuração onde os mesmos serão posicionados de maneira que possa ocorrer a formação de um complexo estável. Essa interação é importante para analisar como um ligante pode ser modificado para melhorar a interação biológica (MACHADO, 2011). O objetivo deste trabalho é estudar as interações do ligante complexo dimérico di-l-cloro-bis [cloro (4,7-dimetil-1, 10-fenantrolina) cádmio (II)] (WARAD et al. 2012) com as moléculas da E. coli (WOLFOVA, 2009) e da S. aureus (SHARP, 2007), depositadas no banco de dados PDB (Protein Data Bank) com os respectivos códigos 2R96 e 2O6P.
Material e métodos
A docagem aconteceu após a otimização da geometria estrutural do ligante de cádmio através dos softwares GauusView e Gaussian 09, sendo estudada sua interação com duas macromoléculas enzimáticas. Para os cálculos foi utilizado o software AutoDock 1.5.6 para o preparo do ligante e da macromolécula, onde foi feita a adição de hidrogênio e a realização do cálculo Gasteiger fazendo a mesclagem não polar, sendo estes preparados no formato .pdbqt. Foram feitas simulações moleculares distintas, na E. coli o grid foi centralizado nas coordenadas X, Y, Z (28.215 -50.354 30.500) do aminoácido TYR11 de cadeia A, e na S. aureus nas coordenadas X, Y e Z (-11.138 -56.133 -12.612) do aminoácido TYR132 de cadeia A, ambas com uma caixa cúbica de 60 x 60 x 60 pontos utilizando um parâmetro metálico AD4. O algoritmo adotado no processo foi o Lamarckian GA. Durante a simulação ocorreu 100 corridas com 150 populações e evals long, por fim analisando as conformações e os agrupamentos moleculares (ROCHA, 2018; FERREIRA, 2015).
Resultado e discussão
Os resultados para as simulações do complexo composto pelo ligante e a
proteína 2O6P como parâmetro possui energia de ligação igual a -7.94 kcal
mol-1 e constante de inibição de 1.51 µM, ocorrendo nessa interação 100
corridas e 100 conformações, não havendo, nesse complexo formação de pontes
de hidrogênio, gerando também como resíduos ALA49, ASP45, ILE48, LYS40,
ILE138, SER47, THR46, TYR132 e TYR136 (Fig. 1A, 1B) . Essas informações
podem ser observadas na Tabela 1.
Já no complexo obtido pelo ligante em conjunto com a proteína 2R69 obteve-se
como resultado uma energia de interação -6.61 kcal mol-1 e uma constante de
inibição de 1.51 µM. Nessa interação, como na anterior, ocorreram 100
corridas e 100 conformações, não havendo também, nesse complexo, formação de
ponte de hidrogênio. As interações hidrofóbicas ocorreram nos aminoácidos
ALA50, ARG78, ASP168, GLY114, GLY167, MET10, PHE79, PRO76, SER112, THR113,
THR77 e TYR11 (Fig 1C, 1D).
Ambas moléculas demostraram uma afinidade de interação entre ligante e
macromolécula aceitável, sendo a interação da enzima de Staphylococus aureus
(2O6P) a com valores de energia de ligação mais próximos de -8,00 kcal mol-
1.
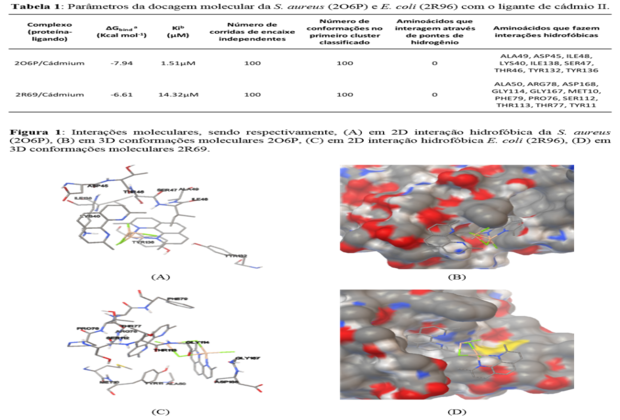
Conclusões
Foi perceptível a eficiência do processo de docagem nas duas enzimas com o ligante de cádmio, no qual um excelente rendimento nas interações hidrofóbicas moleculares pôde ser observado. Por meio dos dados obtidos foi possível notar que a enzima extraída da S. aureus, resultante do processo de simulação molecular, foi a que apresentou efeito mais satisfatório sob os parâmetros de interação previstos para esse estudo, proporcionando um grande potencial do ligante para inibição dessa doença.
Agradecimentos
Ao Prof. Dr. Jefferson Almeida Rocha pelo apoio e suporte na realização deste estudo, aos técnicos por todo auxílio durante as pesquisas computacionais, e aos membros
Referências
BAGNOLI, Fabio; RAPPUOLI, Rino; GRANDI, Guido. Staphylococcus aureus: Microbiology, Pathology, Immunology, Therapy and Prophylaxis. Switzerland: Springer, 2018. 540 p. v. 409.
BATABYAL, Biswajit. Oral Carriage & Suffering of Staphylococcus Aureus: Oral Infection & Staph.Aureus. New Delhi: Educreation Publishing, 2017. 137 p.
BERG, Howard C. E. coli in Motion: Biological and Medical Physics, Biomedical Engineering. New York: Springer Science & Business Media, 2008. 134 p.
CLERMONT, Olivier; BONACORSI, Stéphane; BINGEN, Edouard. Rapid and simple determination of theEscherichia coli phylogenetic group. Applied and environmental microbiology, v. 66, n. 10, p. 4555-4558, 2000.
FERREIRA, Isabelle Mariane de Lima. Estudo por simulação molecular do sistema proteína quinase-inibidores NATAL, RN 2015. 2015. Trabalho de Conclusão de Curso. Universidade Federal do Rio Grande do Norte.
FETSCH, Alexandra. Staphylococcus aureus. United States: Imprensa Acadêmica, 2017. 316 p.
MACHADO, Karina dos Santos. Seleção eficiente de conformações de receptor flexível em simulações de docagem molecular. 2011.
ROCHA, Jefferson A. et al. Computational quantum chemistry, molecular docking, and ADMET predictions of imidazole alkaloids of Pilocarpus microphyllus with schistosomicidal properties. PloS one, v. 13, n. 6, p. e0198476, 2018.
SHARP, Katherine H. et al. Crystal structure of the heme-IsdC complex, the central conduit of the Isd iron/heme uptake system in Staphylococcus aureus. Journal of Biological Chemistry, v. 282, n. 14, p. 10625-10631, 2007.
SUSSMAN, Max. Escherichia Coli: Mechanisms of Virulence. Australim: Cambridge University Press, 1997. 639 p.
WARAD, Ismail et al. Novel di-μ-chloro-bis [chloro (4, 7-dimethyl-1, 10-phenanthroline) cadmium (II)] dimer complex: synthesis, spectral, thermal, and crystal structure studies. Research on Chemical Intermediates, v. 39, n. 6, p. 2451-2461, 2013.
WOLFOVA, Julie et al. Structural organization of WrbA in apo-and holoprotein crystals. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, v. 1794, n. 9, p. 1288-1298, 2009.











