Uso da química quântica computacional para obtenção dos descritores de reatividade global das moléculas encontrada no extrato da Hylocereus undatus.
ISBN 978-85-85905-23-1
Área
Iniciação Científica
Autores
Paes da Silva, L. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Gomes Batista, G. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Carpina de Oliveira Filho, M.A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; de Kássio Vieira Monteiro, N. (UNIVERSIDADE FEDERAL DO CEARA) ; de Lima Neto, P. (UNIVERSIDADE FEDERAL DO CEARA) ; Silva Marinho, E. (UNIVERSIDADE ESTADUAL DO CEARÁ)
Resumo
Foi realizado um estudo teórico sobre os índices de reatividades global das moléculas butil- tetradecano-6-sulfonato, Mono(2-etilhexil)ftalato, 1-O-(2-etilhexil)2-O-(6- etiloctan-3-il) benzene-1,2-dicarboxilato, que possuem pouco estudo sobre suas atividades, encontradas nas pitaya (fruta do dragão). Com os dados das energias obtidos através de cálculos DFT das moléculas em estado neutro e fase gasosa, em B3LYP / 6-31G (d,p), foi possível obter os índices de reatividades química como: Afinidade Eletrônica, Potencial de ionização, GAP (HOMO-LUMO), Potencial químico, eletronegatividade , dureza, maciez e eletrofilicidade. Diante dos dados obtidos, concluiu-se dentre as três moléculas, a que tende a ser a mais reativa é a mono(2-etilhexil)-ftalato com os maiores índices de reatividade global.
Palavras chaves
Reatividade; DFT; Química Teórica
Introdução
A fruta pitaya, popular chamada fruta do dragão, Hylocereus undatus é o cultivo mais abundante de frutas exóticas documentadas com 34.150 sites de 50.100 locais de plantio ou 62,2% do plantio total Território do Norte da Austrália [1]. É encontrado também no sul do estado do Ceará, Brasil, que é de bastante interesse para exportação brasileira [2]. Esta fruta apresenta antioxidante e citotóxica [2], e seus produtos possuem várias propriedades úteis, incluindo agentes corantes, propriedades espessantes, alta capacidade antioxidante e fibra alimentar [4]. Portanto, este trabalho tem como objetivo trazer visão sobre as propriedades de reatividade química, das moléculas butil-tetradecano-6-sulfonato, Mono(2-etilhexil)-ftalato, 1-O-(2-etilheiyl) 2- O-(6-etiloctan-3-il)-benzene-1,2-dicarboxilato, encontradas nesta fruta, com base nos cálculos em DFT. Pelos métodos da química quântica realizamos uma descrição teórica dos índices de reatividade, e fazer uma comparação entre as moléculas estudadas. No âmbito da Teoria Funcional da Densidade, é possível definir parâmetros de reatividade global que forneçam informações sobre o comportamento geral de uma molécula. Segundo o teorema de Koopmans e na teoria de Parr [5-8], as propriedades globais podem ser obtidas pelas energias orbitais de fronteira (FMO) que são o HOMO e o LUMO. Índices de reatividade global: o potencial químico (μ), a eletronegatividade (χ), dureza (η) e macies(S), eletrofilicidade (ω).
Material e métodos
Neste trabalho, foi utilizado o software Orca 4.0.1.2 [14] para todos os cálculos quânticos, no sistema operacional Linux. Inicialmente foi realizado um desenho das moléculas em estudo, no software Avogadro referencia Avogadro. A estrutura desenhada foi pré-otimizada em PM7 (Parameterized Model 7), utilizando o software MOPAC2016 versão 18.063w[15]. Em seguida foi realizado os cálculos de otimização geométrica em nível DFT, utilizando como funcional o B3LYP, [16] um funcional híbrido que apresenta resultados bastante satisfatórios em moléculas orgânicas, e como conjunto de base a 6- 31 G (d,p) (Valence Triple Zeta + Polarization on All Atoms). Todos os cálculos foram feito em fase gasosa, e as frequência vibracionais para todos os casos foram checados para se certificar de que os pontos estacionários eram mínimos. Depois de obtido as energias geradas pelos cálculos em DFT, podemos calcular os parâmetros de reatividade que são definidas nas formulas: GAP = EHOMO- EHOMO; I = - EHOMO; A = -ELUMO; X = (I+A) /2; μ = -(I+A) /2; η = (I – A) /2; S = 1/ η; ω = μ^2/2η; ω- = (3I+A)^2 /16(I−A); ω+ = (I+3A)^2 /16(I−A); ∆ω+-= (ω+) − (−ω-).
Resultado e discussão
A otimização de geométrica é uma etapa importante da maioria dos cálculos
químicos quânticos, no qual é uma componente chave da maioria dos estudos de
química computacional que se visam à estrutura e reatividade das moléculas.
A
figura 1 mostra as estruturas das moléculas otimizadas em DFT em B3LYP / 6-
31
G (d,p) em fase gasosa. M1, M2, M3 mostrados na tabela 1 se referem à Mono
(2-
etilhexil)-ftalato, 1-O-(2-etilhexil), 2-O-(6-etiloctan-3-il)-benzene-1,2-
dicarboxilato, butil-tetradecano-6-sulfonato respectivamente. Os resultados
dos descritores de reatividade global mostram que, de acordo com o índice do
potencial de ionização, a molécula M1 requer menos energia para remover
elétron no estado fundamental, e a M3 requer a maior energia. Na análise da
afinidade eletrônica, A M3 foi o único que obteve valor significativo, isso
significa que ele não tem a capacidade de aceitar um elétron facilmente,
comparado as outras duas. A molécula M1 obteve a maior afinidade eletrônica,
mostrando que ele tem a maior tendencia para formar ânion. Sobre a
eletronegatividade, aponta que M1 mostra uma melhor tendência a atrair
elétrons. No quesito dureza química, de acordo com a teoria de Pearson [17-
18], pode ser interpretada que, quanto maior a dureza química, maior a
estabilidade, e conclui-se da tabela que a molécula mais estável é a M3. As
moléculas foram avaliadas por meio de eletrodoação e eletroreceptor para
encontrar a susceptibilidade de doar ou aceitar uma pequena quantidade de
carga necessária para participar de interações químicas. Além disso,
utilizou-
se o ∆ω-+ para obter valores mais representativos de eletrofilicidade para
expor os pontenciais de eletrodoação (ω-) e eletroreceptor (ω+). Os valores
são mostrados na tabela 1 indica uma boa natureza eletrofílica global da M1.
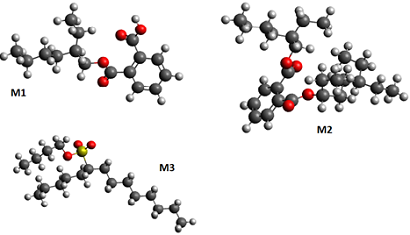
Estrutura das moleculas M1, M2, M3 após a otimização DFT B3LYP / 6-31 G (d,p)
Conclusões
Estudo teórico das reatividades químicas de três moléculas encontradas na pitaya, utilizando os métodos DFT em fase gasosa, nos forneceu um comparativo quantitativo entre as moléculas estudadas. Foi calculado os valores energéticos dos orbitais de fronteira, foi obtido informações sobre a atividade global química das moléculas. Seguindo os dados das descrições da reatividade global calculadas neste trabalho, chegado à comparação dos índices dos descritores: Dureza, eletronegatividade e eletrofilicidades, se conclui que a molécula Mono- (2-etilhexil)-ftalato apresenta uma maior reatividade.
Agradecimentos
A Fundação Cearense de Apoio à Pesquisa (FUNCAP), ao Grupo de Química Teórica (GQT) e ao Núcleo de Processamento de Alto Desempenho (NPAD).
Referências
1. KENT F, YAN D (2013) Collation of health literature for tropical exotic fruits and extracts. Australia.
2. ALMEIDA, B. I. E., CÔRREA, M. C. M., CAJAZEIRA, J. P., QUEIROZ. R. F., BARROSO, M. M .A., MARQUES, V. B. (2016) Cultivo de Hylocereus sp. com enfoque na propagação vegetativa, sombreamento e adubação mineral.
3. LUO, H., CAI, Y., PENG, Z., LIU, T., YANG, S., (2014) Chemical composition and in vitro evaluation of the cytotoxic and antioxidant activities of supercritical carbon dioxide extracts of pitaya (dragon fruit) peel.
4. BELLEC, L. F., F. VAILLANT and E. IMBERT. (2006). Pitahaya (Hylocereus.spp.): A new fruit crop, a market with a future. Fruits, 61: 237-250.
5. R.G. PARR, W. YANG, Density Functional Theory of Atoms and Molecules, Oxford University Press, New York, 1989.
6. R.G. PARR, L. SZENTPÁLY, and S. Liu. J. Am. Chem. Soc. 121, 1922 (1999).
7. CHATTARAJ P (2009) Chemical reactivity theory–a density functional view. CRC Press, Taylor & Francis Group, Boca Raton.
8. FRAU, j., GLOSSMAN‑MITNIK, D., (2018) Conceptual DFT study of the local chemical reactivity of the dilysyldipyrrolones A and B intermediate melanoidins.
9. R.L. PRIOR, G. Cao In vivo total antioxidant capacity, Comparison of different analytical methods. Free Radic Biol Med 27(11-12), (1999) 1173-1181.
10. A. MEDJDOUB NÉE GHOMRI, Contribution à l'étude de la réactivité chimique à l'aide de lan DFT conceptuelle. Application à la chimie des hétérocycles, (2012).
11. H. MORREL, Modelling hearing thresholds in the elderly, Statistic in Medicine, Vol. 10, (1991) 1453-1464.
12. GÁZQUEZ JL, CEDILLO A, VELA A, Electrodonating and electroaccepting powers, J Phys Chem A 111(10):1966–1970, 2007.
13. GÁZQUEZ JL, Perspectives on the density functional theory of chemical reactivity, J Mex Chem Soc 52:3–10, 2008.
14. NEESE, FRANK (2018). "Software update: The ORCA program system, version 4.0". Wiley Interdisciplinary Reviews: Computational Molecular Science.
15. JAMES J. P. STEWART, (2016). Stewart Computational Chemistry.
16. A.D. BECKER (1992). Density‐functional thermochemistry. III. The role of exact exchange.
17. PARR RG, PEARSON RG, Absolute hardness: Companion parameter to absolute electronegativity, J Am Chem Soc 105(26):7512–7516.
18. PEARSON RG, Chemical hardness and density functional theory, J Chem Sci 117(5):369 -377, 2005.











