AVALIAÇÃO DO COMPORTAMENTO DA REAÇÃO DE ACETATO DE ETILA COM METANOL NA PRESENÇA DE SÓLIDOS ÁCIDOS DE NIÓBIO
ISBN 978-85-85905-23-1
Área
Química Inorgânica
Autores
Bittencourt, P.V.Q. (UNIVERSIDADE FEDERAL DE VIÇOSA) ; Oliveira, A.F.A. (UNIVERSIDADE FEDERAL DE VIÇOSA) ; Leles, L.C.A. (UNIVERSIDADE FEDERAL DE VIÇOSA) ; Vieira, B.B. (UNIVERSIDADE FEDERAL DE VIÇOSA) ; Silva, M.J. (UNIVERSIDADE FEDERAL DE VIÇOSA) ; Sato, A.G. (UNIVERSIDADE FEDERAL DE VIÇOSA)
Resumo
O objetivo deste estudo foi avaliar o comportamento da reação modelo de transesterificação acetato de etila e metanol utilizando diferentes catalisadores sólidos: ácido de nióbio, óxido de nióbio e fosfato de nióbio. Os produtos da reação foram analisados em cromatografia gasosa com detector do tipo FID. Apenas o fosfato de nióbio apresentou atividade catalítica e o sólido foi analisado por espectroscopia no infravermelho para confirmação dos constituintes. Realizou-se reações para estudo de reuso do catalisador e teste lixiviação. Observou-se a ocorrência de lixiviação de ácido no sistema reacional. Utilizando ácido fosfórico como catalisador homogêneo, não se observou conversão do reagente limitante, sugerindo que as propriedades catalíticas estejam na interface nióbio-fosfato.
Palavras chaves
Transesterificação; Catálise heterogênea; Nióbio
Introdução
Os ésteres orgânicos ocorrem de forma natural em óleos, gorduras, flores e frutas sendo responsáveis por odores e sabores característicos. Uma grande diversidade de ésteres é empregada com o objetivo de conferir sabor e odores a diversos produtos, sendo muito utilizados nas indústrias de perfumaria, de alimentos, de cosméticos e farmacêutica, além de serem espécies intermediárias nas indústrias de plásticos e de química fina (ALONSO et al.,2009; TOMKE, RATHOD, 2015). A obtenção de ésteres pode ocorrer através de uma reação de transesterificação entre um éster e um álcool, a qual não ocorre de forma espontânea, necessitando da presença de um catalisador para a formação de um novo éster e um novo álcool (MENEGHETTI et al., 2013). Os catalisadores diminuem a energia de ativação e aumentam a velocidade de reação (RIBEIRO, SOUZA, 2011). Os catalisadores podem ser classificados em três categorias quanto às suas propriedades físicas: catalisadores homogêneos, catalisadores heterogêneos e biocatalisadores. Os catalisadores homogêneos e heterogêneos podem ser ácidos ou básicos (MEHER et al., 2006;SHARMA et al., 2009; SHARMA et al., 2011). Catalisadores homogêneos têm algumas vantagens sobre outros tipos por possuírem alta atividade, melhor custo-benefício, e são facilmente adequados às condições da reação (OLUTOYE et al., 2016). Porém, possuem uma grande desvantagem por não serem facilmente recuperados podendo gerar resíduos indesejáveis de difícil disposição final. Os catalisadores heterogêneos possuem a vantagem de serem insolúveis, podendo ser separados por filtração e possivelmente reutilizados (ZHOU et al., 2015). Outra vantagem significativa é a versatilidade destes. O mesmo catalisador pode, por exemplo ser utilizado em reações de esterificação e de transesterificação na produção de biodiesel (SANI et al., 2014). A corrosão é um grande problema industrial. A utilização de catalisadores ácidos aumenta o potencial corrosivo de determinada reação. Este problema é mais acentuado com os catalisadores ácidos homogêneos. Com os catalisadores ácidos heterogêneos, mesmo os que possuem sítios ácidos de Brønsted-Lewis,os problemas de corrosão são minimizados. Reações catalisadas de forma heterogênea dependem da área superficial do catalisador empregado, já que, as reações ocorrem nas superfícies dos mesmos. Nessas reações, os mecanismos de adsorção, etapa de reação e os mecanismos de dessorção são fundamentais para se avaliar a atividade catalítica. Os mecanismos de adsorção e dessorção não devem ser mais lentos do que a velocidade da reação para poder se utilizar o catalisador em estudo(RIBEIRO, SOUZA, 2011). Dessa forma, são muito comuns estudos com areação modelo entre acetato de etila e metanol formando acetato de metila e etanol,para determinar parâmetros operacionais e a viabilidade da utilização do catalisador (MARCINIUK, 2012). Para qualquer reação de transesterificação, os parâmetros que irão influenciar no equilíbrio da reação são a natureza do catalisador e a dosagem, se é ácido ou básico, se é homogêneo ou heterogêneo, o tipo de álcool e a razão molar álcool:éster, temperatura, pureza de reagentes,agitação do meio reacional, entre outros. As reações de transesterificação são reações reversíveis e, por isso, é importante deslocar a reação a favor da formação dos produtos, sendo uma das maneiras a utilização de excesso de álcool. Segundo Tanabe (1987) conforme citado por Sun et al. (2007) o pentóxido de nióbio (Nb2O5) é um sólido branco, estável no ar e insolúvel em água. O óxido de nióbio hidratado (Nb2O5.nH2O) possui uma acidez forte conforme a titulação de Hammett (HO≤-5,6), sendo equivalente a cerca de 70% de ácido sulfúrico. O óxido de nióbio possui os sítios ácidos de Lewis e Brønsted (JEHNG, WACHS, 1990, apud SUN et al., 2007) exibindo uma alta atividade para reações catalisadas por ácido nas quais as moléculas de água participam. Conforme Nowak e Ziolek (1999 apud SUN et al., 2007) o fosfato de nióbio(NbOPO4) tem uma estrutura semelhante ao Nb2O5 mas com uma maior acidez (HO≤-8,2). Os grupos terminais P-OH e Nb-OH coexistem nas superfícies dos catalisadores de nióbio em massa e impregnados (ZIOLEK, 2003). Os sítios de ácidos de Lewis em catalisadores de fosfato de nióbio são os cátions Nb5(mais) coordenativamente insaturados e os grupos P-OH são ácidos de Bronsted mais fortes do que Nb-OH (ARMAROLI et al. 2000, apud SUN et al., 2007). Os estudos de Sun et al. (2007) confirmaram que o fosfato de nióbio é mais ácido do que o óxido hidratado devido a sua maior área superficial. Dessa maneira, o presente trabalho estudou a reação de transesterificação do acetato de etila com metanol com o uso de catalisadores sólidos, à base de nióbio, visando obter seus produtos de modo mais seletivo e eficiente.
Material e métodos
Um teste preliminar para avaliar a atividade catalítica dos sólidos óxido de nióbio, ácido de nióbio e fosfato de nióbio foi realizado. Utilizou-se a razão molar 1:6 acetato de etila:metanol (MARCINIUK, 2012; CASTRO, 2013), volume total de 5 mL e 4% (m/m) de cada sólido separadamente. Fez-se um branco, onde só se inseriu os reagentes. Os reagentes foram misturados por agitação magnética, a 50°C durante 60 min (CASTRO, 2013), feitos em duplicata. As amostras foram centrifugadas, filtradas em membranas de 0,22 μm e analisadas por cromatografia gasosa. As análises anteriores mostraram que apenas o fosfato de nióbio possuía atividade catalítica para a reação. Em seguida, avaliou-se o efeito da concentração do catalisador (2 e 4% (m/m)), temperatura (20°C, 30°C, 40°C e 50°C) e tempo (3, 5, 7, 10, 15, 20, 25, 30, 40, 50 e 60 min) na conversão da reação. Utilizando a razão molar de acetato de etila:metanol de 1:6 no volume total de 20 mL. Os experimentos foram feitos em balão de três vias,em banho maria e agitação magnética, ligado a um sistema de refrigeração(VAN DE STEENE, 2012). As amostras retiradas foram resfriadas, centrifugadas e filtradas para posterior análise cromatográfica. A lixiviação é o processo onde o catalisador migra da fase sólida para o meio reacional, afetando a capacidade de reuso e por isso é indesejável.Testes de reuso e lixiviação foram realizados com a razão molar acetato deetila:metanol 1:6, concentração de catalisador em 4% (m/m) e temperatura de 20 °C. No teste de lixiviação, o catalisador foi adicionado aos reagentes,após 30 segundos, 5 mL foram retirados, filtrados e adicionados a outro tubo. Ambos os tubos ficaram a 20°C por 60 min, foi retirada uma amostra de cada tubo para análise. O teste de reuso consistiu na retirada de uma alíquota do sistema após 60 min para análise, secagem do catalisador e nova reação utilizando-o mantendo as proporções e as condições previamente utilizadas. O processo de produção de fosfato de nióbio pode acarretar na presença de ácido fosfórico residual no sólido. Para testar a presença do mesmo no meio reacional, aferiu-se o pH dos reagentes e após a mistura dos reagentes e do catalisador por 30 min. As amostras das reações foram analisadas por cromatografia gasosa com detector de ionização em chama (FID), cromatógrafo a gás CG-2010 Plus marca SHIMADZU, série C118047, utilizando coluna capilar Carbowax 20M, com aquecimento em rampa de temperatura iniciando a 60°C e aquecimento de 8°C/min, até 100°C, com o gás de arraste sendo uma mistura de H2, N2 e ar com vazões 40 mL/min, 30 mL/min e 400 mL/min, respectivamente. Realizou-se uma curva padrão com acetato de metila. Obteve-se o espectro na região do infravermelho referente ao catalisador ativo, através de transformada de Fourrier acoplada à técnica de Reflectância Total Atenuada (FTIR-ATR) nos comprimentos de onda que variam entre 400 a 4000 cm-1, utilizando-se o equipamento Varian 660-IR com dispositivo PIKE Gladi ATR.
Resultado e discussão
Testes preliminares
A reação conduzida sem nenhum tipo de catalisador não apresentou conversão
significativa. O cromatograma, Figura A, demonstra a ausência dos picos dos
produtos, indicando a necessidade de um catalisador para que areação ocorra.
Observou-se também que as reações conduzidas utilizando óxido de
nióbio,Figura B, e ácido de nióbio, Figura C, não ocorreram, mostrando assim
que tais substâncias não atuaram como catalisador nas condições de reação
estudadas. No entanto, a reação ocorreu para o fosfato de nióbio como
catalisador, visto que existem no cromatograma, Figura D, quatro picos,
apontando a formação do acetato de metila e do etanol, os produtos da reação
de transesterificação.
Com base nesses testes preliminares, todas reações e testes subsequentes
foram realizados utilizando o fosfato de nióbio comocatalisador.
Curva padrão
A partir da plotagem dos valores de área correspondentes ao acetato de
metila, fez-se a curva padrão mostrada na Figura E, que obedeceu a
correlação linear descrita na mesma, onde o Y representa a concentração do
acetato de metila (mol/L) e o X representa a área do cromatograma referente
ao pico do acetato de metila. De acordo com essa equação, pode-se então
correlacionar os valores de área de acetato de metila dos demais
cromatogramas afim de se obter a concentração desse produto nas reações e
testes realizados.
Reações
As reações realizadas mostraram uma conversão de equilíbrio decrescente de
acordo com o aumento da temperatura de reação quando se utilizou uma
porcentagem de catalisador de 2% (m/m), conforme Figura F.
Com a análise do gráfico, da Figura F, pode-se notar que o sistema reacional
apresenta uma tendência de valores de conversão constantes para todos os
tempos de retirada de amostra, o que sugere que o sistema atinge o
equilíbrio termodinâmico já no primeiro ponto analisado, referente a 3
minutos de reação, para todos os níveis de temperatura. Comportamento
semelhante observa-se na Figura G, correspondente às reações realizadas
utilizando 4% (m/m) de catalisador.
Quando se compara as Figuras F e G, nota-se que, mesmo em concentrações
baixas (4% (m/m) e 2%(m/m)) obtém-se conversões próximas a 50%, mostrando um
bom potencial do catalisador. Espera-se que em concentrações maiores,
conversões mais altas sejam obtidas.
Teste de reuso
As reações conduzidas para análise do reuso do catalisador tiveram duração
de 1h e temperatura 20 °C e análise imediata no cromatógrafo. Porém,
formação dos produtos não ocorreu. As amostras dos testes anteriores foram
armazenadas em geladeira a 4°C antes das análises no cromatógrafo. Sendo
assim, percebeu-se que a reação continuou ocorrendo, sendo este o motivo das
análises anteriores apresentarem os produtos para tempos inferiores e iguais
a 1h.
Diante deste fato, resolveu-se alterar os parâmetros operacionais do
processo. Com base nos estudos de Pietre et al. (2010), a reação foi
realizada a 60°C e duração de 5 horas. A temperatura em que se realizou o
teste foi definida de forma a ser a mais elevada possível sem que os
reagentes entrassem em ebulição, uma vez que foram conduzidas em tubos de
ensaios fechados e, um possível aumento na quantidade de vapor no sistema
poderia acarretar estouro do tubo. Novamente, a amostra reacional retirada
ao final das 5 horas e filtrada na membrana microporosa, foi analisada em um
pequeno intervalo de tempo e então pode-se notar a partir do cromatograma
obtido a presença dos produtos desejados. Após a evaporação dos solventes do
catalisador, fez-se uma nova reação a 60°C com duração de 5 horas para
avaliar a viabilidade de se reutilizar o fosfato de nióbio como catalisador
da reação.
A concentração obtida de acetato de metila foi 0,9341 mol L-1, a qual
corresponde a uma conversão de 31,14% ao se utilizar o catalisador.
Enquanto, no reuso do catalisador, a concentração de acetato de metila
obtida foi 0,3374 mol L-1 correspondendo a uma conversão de 11,25%. Podendo
se observar que o catalisador se mostrou ativo no reuso, porém com uma menor
atividade catalítica. A considerar baixa atividade do reuso do catalisador
pode indicar que o elemento catalisador não tenha permanecido no sólido.
Teste de lixiviação
A conversão de acetato de metila obtida para o sistema que permaneceu na
presença do catalisador foi 15,42% e a conversão do sistema que teve o
sólido retirado após 30 segundos foi 16,41%. Estes resultados são muito
próximos, por isso um forte indício de que possa ter havido a lixiviação do
elemento catalisador da reação. Uma vez que, a reação prosseguiu mesmo sem a
presença do sólido.
A variação na conversão entre os dois sistemas, pode estar relacionada a
interação entre o catalisador e os reagentes que se torna menor quando o
sólido de nióbio permanece no sistema, indicando que o catalisador está
disperso no meio. Dessa forma o sistema catalítico foi homogêneo e os
métodos de separação utilizados anteriormente não foram devidamente
eficientes para retirar o catalisador e parar a reação. Assim, justifica-se
o fato de todos os pontos retirados ao longo do tempo reacional apresentarem
valores de conversão semelhantes, indicando que a reação continuou ocorrendo
até que o sistema entrasse em equilíbrio.
Teste de pH
O teste de pH mostrou que o pH da solução de reagentes é em torno de 6,30 e
quando o fosfato de nióbio é adicionado ao meio o pH cai para 1,90. O que
mostra a presença de ácido livre no sistema reacional. Fator este que pode
confirmar a suspeita que o catalisador lixivie quando em solução.
Reação catalisada por ácido fosfórico
Realizou-se um teste adicional baseado nas evidências de que se lixiviava um
ácido no sistema reacional e, a partir da composição do fosfato de nióbio,
pressupôs-se que ocorresse a lixiviação do ácido fosfórico.
Afim de saber se era este servindo como catalisador da reação, fez-se uma
reação diretamente com o ácido fosfórico, sendo o sistema reacional composto
apenas dos reagentes, acetato de etila e metanol, e do ácido fosfórico em
proporções de fosfato semelhantes às contidas no fosfato de nióbio.
A reação foi conduzida a 60°C por 5 horas e a amostra retirada ao final da
reação, foi realizada a análise cromatográfica no mesmo intervalo de tempo
das amostras do teste de reuso que apresentaram resultados satisfatórios. O
cromatograma da análise dessa amostra é mostrado na Figura H.
A partir dessa análise notou-se que o ácido fosfórico não catalisa este tipo
de reação de maneira independente, aparecendo picos muito pequenos dos
produtos de reação.
Análise do catalisador em espectroscopia no infravermelho
A caracterização em espectroscopia no infravermelho tornou-se necessária
para avaliar a possível desativação do catalisador quando o teste de reuso
apresentou resultados insatisfatórios. Dessa forma, a caracterização do
sólido in natura, possibilitou a comparação de sua composição naquele
momento com a composição original.
No resultado da análise por espectroscopia no infravermelho para o fosfato
de nióbio (Figura I), observa-se uma banda no comprimento de onda 3344
cm-1, próximo à banda descrita por Júlio (2015), que representa o
estiramento da ligação O-H, que se correlaciona ao grau de hidratação do
catalisador.
O espectro obtido apresenta também um estiramento em 994 cm-1
referente à banda do fosfato, enquanto a banda mostrada em 573
cm-1 refere-se ao estiramento Nb-O, estando estes dados de acordo
com La Cruz et al. (2006). Mostrando assim que o catalisador aqui utilizado
teve suas propriedades preservadas durante os experimentos.
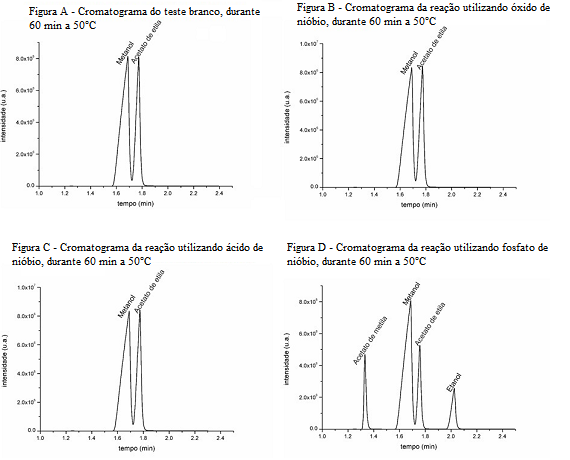
A figura contém as figuras A, B, C e D descritas no texto de resultados e discussão
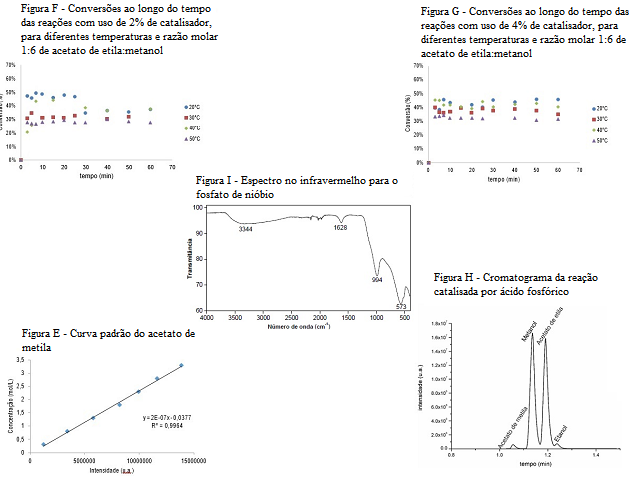
Contém as figuras E, F, G, H e I descritas no texto de resultados e discussão
Conclusões
Com base nos estudos das características dos sólidos de nióbio como catalisadores da reação de transesterificação entre o acetato de etila e o metanol, notou-se que apenas o fosfato de nióbio tem atividade catalítica. Fundamentado nos testes das propriedades do catalisador, nota-se que ocorreu lixiviação de ácido no sistema reacional. Por isso, a reação continuou ocorrendo no período entre a retirada da amostra do sistema reacional e a análise cromatográfica, uma vez que o catalisador lixiviado não pôde ser separado por filtração. Dessa forma, os dados apresentados, coletados durante o tempo reacional, na realidade mostram os valores de conversão em um tempo muito além do momento em que cada amostra foi retirada, estando as amostras de todos os pontos no equilíbrio termodinâmico, atingindo no tempo em que se aguardava análise. Contudo, a partir da observação do comportamento reacional, quando utilizou- se o óxido de nióbio e o ácido fosfórico de forma independente como catalisador, vê-se que, dessa forma, nenhum deles catalisou a reação desejada. Pode-se sugerir que a interface nióbio-fosfato atua como catalisador da reação. Para emprego do catalisador em processos industriais, seria interessante maior suporte da substância catalítica de forma a ancorar o fosfato de nióbio, evitando lixiviação de ácido livre no sistema e, assim, melhorar o desempenho da reação para que não promova a degradação dos equipamentos.
Agradecimentos
Referências
ALONSO, D. M.; GRANADOS, M. L.; MARISCAL, R.; DOUHAL A. Polarity of the acid chain of esters and transesterification activity of acid catalysts. Journal of Catalysis, v. 262, n. 1, p. 18-26, 2009.
ARMAROLI, T.; BUSCA, G.; CARLINI, C.; GIUTTARI, M.; GALLETTI, A. M. R.; SBRANA, G. Acid sites characterization of niobium phosphate catalysts and their activity in fructose dehydration to 5-hydroxymethyl-2-furaldehyde. Journal of Molecular Catalysis A: Chemical, v. 151, Issues 1–2, p. 233–243,2000.
CASTRO, C.S. Óxidos mistos de magnésio e alumínio contendo lítio e cálcio como catalisadores para transesterificação etílica. 2013 (Tese Doutorado). Universidade Federal de São Carlos - UFSCar, São Carlos-SP.
DE LA CRUZ, M. H. C.; DA SILVA, J. F. C.; LACHTER, E. R. Catalytic activity of niobium phosphate in the Friedel–Crafts reaction of anisole with alcohols. Catalysis Today, v.118, p.379–384, 2006.
JEHNG, J., WACHS, I. E. The molecular structures and reactivity of supported niobium oxide catalysts. Catalysis Today, v. 8, Issue 1, Pages 37-55, 1990.
JULIO, A, A. Reações de cetalização do glicerol com diferentes cetonas catalisadas por SnCl2. 2015. 98f. Dissertação (Mestrado em Agroquímica). Universidade Federal de Viçosa, Viçosa, 2015.
MARCINIUK, L. L. Síntese de titanatos alcalinos e avaliação na transesterificação catalítica. 2012 (Tese Doutorado). Universidade Federal de Sao Carlos - UFSCar, Sao Carlos-SP.
MEHER, L. C.; SAGARM, D. V.; NAIK, S. N. Technical aspects of biodiesel production by transesterification - a review. Renewable and Sustainable Energy Reviews, v. 10, n. 3, p. 248-268, 2006.
MENEGHETTI, S. M. P.; MENEGHETTI, M. R.; BRITO, Y. C. A Reação de Transesterificação, Algumas Aplicações e Obtenção de Biodiesel. Revista Virtual de Química, 2013, 5 (1), 63-73.
NOWAK, I., ZIOLEK, M. Niobium Compounds: Preparation, Characterization, and Application in Heterogeneous Catalysis. Chem. Rev., 99, pp. 3603–3624, 1999.
OLUTOYE, M. A.; WONG, S. W.; CHIN, L. H.; AMANI, H.; ASIF, M.; HAMEED, B. H. Synthesis of fatty acid methyl esters via the transesterification of waste cooking oil by methanol with a barium-modified montmorillonite K10 catalyst. Renewable Energy, v. 86, p. 392-398, 2016.
PIETRE, M. K.; ALMEIDA, L. C. P.; LANDERS, R.; VINHAS, R. C. G.; LUNA, F. J. H3PO4- and H2SO4- treated niobic acid as heterogeneous catalyst for methyl ester production. Reaction Kinetics, Mechanisms, and Catalysis. V. 99, p. 269- 280, 2010.
RIBEIRO, N. F. P.; SOUZA, M. M. V. M. Nanocatálise: aspectos fundamentais e aplicações. Com Ciência, n.130, Campinas, 2011.
SANI, Y. M.; DAUD, W. M. A. W.; AZIZ, A. R. A. Activity of solid acid catalysts for biodiesel production: A critical review. Applied Catalysis A: General. Volume 470, Pages 140–161, 2014.
SHARMA, B. K.; SUAREZ, P. A. Z.; PEREZ, J. M.; ERHAN, S. Z. Oxidation and low temperature properties of biofuels obtained from pyrolysis and alcoholysis of soy bean oil and their blends with petroleum diesel. Fuel Processing Technology, v. 90, p.1265–71, 2009.
SHARMA, Y. C.; SINGH, B.; KORSTAD, J. Latest developments on application of heterogeneous basic catalysts for an efficient and ecofriendly synthesis of biodiesel: a review. Fuel; v. 90, p. 1309–24, 2011.
SUN, Q.; FU, Y.; YANG, H.; AUROUX, A.; SHEN, J. Dehydration of methanol to dimethyl ether over Nb2O5 and NbOPO4 catalysts: Microcalorimetric and FT-IR studies. Journal of Molecular Catalysis A: Chemical, v. 275, Issues 1–2, p. 183– 193, 2007.
TANABE, K. Niobic acid as an unusual acidic solid material. Materials Chemistry and Physics, v. 17, Issues 1–2, p. 217-225,1987.
TOMKE, P. D.; RATHOD, V. K. Ultrasound assisted lipase catalyzed synthesis of cinnamyl acetate via transesterification reaction in a solvent free medium. Ultrasonics Sonochemistry, v. 27, p. 241-246, 2015.
VAN DE STEENE, E.; DE CLERCQ.; THYBAUT, J. W. Adsorption and reaction in the transesterification of ethyl acetate with methanol on Lewatit K1221. Journal of Molecular Catalysis A: Chemical, v. 359, p. 57-68, 2012.
ZHOU, Q.; CHANG, H.; CHANG, F.; LI, H.; PAN, H.; XUE, W.; HU, D.; YANG, S. Nano La2O3 as a heterogeneous catalyst for biodiesel synthesis by transesterification of Jatropha curcas L. oil. Journal of Industrial and Engineering Chemistry, v. 31, p. 385-392, 2015.
ZIOLEK, M. Niobium-containing catalysts—the state of the art. Catalysis Today, v. 78, p. 47-64, 2003.











