Investigação da decomposição do peróxido de hidrogênio utilizando iodeto de potássio como catalisador
ISBN 978-85-85905-23-1
Área
Físico-Química
Autores
Cardoso, E. (UFPA) ; Pereira, R. (UFPA) ; Souza, L. (UFPA) ; Morais, R. (UFPA) ; Cardoso Filho, J. (UFPA)
Resumo
O estudo da cinética química é de fundamental importância na formação dos profissionais de química. No presente trabalho, analisou-se a importância de parâmetros operacionais, tais como: pressão, concentração e tempo de decomposição do peróxido de hidrogênio utilizando iodeto de potássio como catalisador. No procedimento experimental foi desenvolvido um esquema simples com o objetivo de investigar a decomposição do H2O2 através da coleta de O2 em um manômetro. De forma bastante eficiente foi demonstrado a ordem da reação química (primeira ordem) em questão e calculada a constante de velocidade da reação química (K=10,87.10-5s-1). Os resultados obtidos demonstraram-se satisfatórios.
Palavras chaves
Cinética química; peróxido de hidrogênio; iodeto de potássio
Introdução
O Peróxido de Hidrogênio é um oxidante muito versátil com aplicações em diversos ramos industriais. É citado como o oxidante mais eficiente na conversão de SO2 em SO2-4, um dos maiores responsáveis pela acidez da água da chuva. O peróxido de hidrogênio é empregado nos processos de branqueamento nas indústrias têxteis, de papel e celulose. Também é utilizado no controle da poluição, muitas vezes com ênfase no monitoramento ambiental (MATTOS, et.al 2003). A decomposição do H2O2 ocorre geralmente a baixas temperaturas, sendo que na presença de catalisadores pode ocorrer até mesmo em temperaturas próximas a 0°C. Outros fatores como a presença de ácidos, ânions e suas concentrações no meio reacional, assim como a concentração inicial de peróxido de hidrogênio também podem afetar a reação, podendo inibi-la ou favorecê-la. Além dos fatores anteriormente mencionados, as características do catalisador empregado têm o poder de influenciar na velocidade de decomposição do H2O2 (CHOUDHARY et al,2006). O objetivo neste trabalho é entender a influência do Iodeto de Potássio (KI) e de fatores, como: pressão, concentração e tempo na decomposição do H2O2.
Material e métodos
Foi estudada a reação de decomposição do peróxido de hidrogênio a temperatura ambiente. A partir de uma solução a 30%(v/v) de peróxido, diluiu-se 30 ml da solução em 500 mL de água destilada. Analisou-se 100 mL da amostra, na qual foi adicionada 5 mL de iodeto de potássio. Introduziu-se a solução em um balão volumétrico e acoplou-se a um manômetro. A válvula foi fechada tendo o cuidado de verificar o equilíbrio hidrostático, a fim de medir a variação de pressão realizada pela formação de O2. Com auxílio de um cronômetro observou-se, a partir do equilíbrio hidrostático,o deslocamento no manômetro. O procedimento descrito foi realizado em duplicata.
Resultado e discussão
A reação de decomposição do peróxido de hidrogênio catalisada por iodeto de potássio como é dada por:
KI + H2O2 → KIO + H2O e
KIO + H2O2 → KI + O2 + H2O.
A velocidade de reação foi avaliada utilizando o método integral, mediante as seguintes equações:
-d[H2O2])/dt =1/2 d[O2]/dt = d[PO2]/dt (1).
E
d[PO2]/dt=kPO2 (2).
Fazendo o desenvolvimento matemático obtemos:
ln((PO2)/(PO20 ))=kt (3).
Sendo: PO2,PO20,k e t – a pressão parcial, a pressão parcial inicial de oxigênio, constante de velocidade e tempo decorrido da reação, respectivamente;
E ainda
PO2=PO20+ρgh (4).
Sendo: rô, g e h - massa específica da água, aceleração gravidade e altura manométrica, respectivamente.
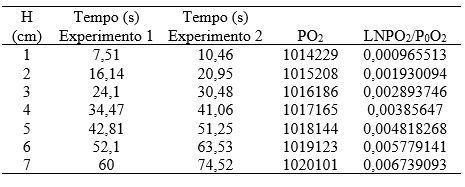
A Tabela 1 apresenta os resultados de altura de deslocamento, e seu respectivo tempo. Além dos valores calculados de pressão parcial a partir da equação 4. E ainda a linearização da pressão para obter a ordem da reação.
Observa-se que no segundo experimento foi necessário mais tempo para chegar a mesma pressão, isso se deve ao uso da solução, pois com o tempo a concentração de reagente diminui, logo a velocidade da reação também diminui.
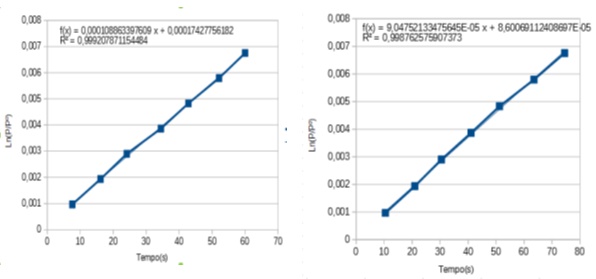
Com os dados da tabela 1 obteve-se os gráfico 1 e o gráfico 2.
A partir dos gráficos foi possível observar que as constantes de velocidade das corridas 1 e 2 são, respectivamente, iguais a 10,87.10-5 e 9,05.10-5, ou seja, apresentam valores satisfatórios.
Resultados
Corridas 1 e 2
Conclusões
A partir da análise dos dados obtidos, a decomposição do H2O2 utilizando o iodeto de potássio como catalisador é descrita por uma reação de primeira ordem. E apesar da diferença de tempo para atingir a mesma pressão, devido à diferença de concentração, as constantes de velocidade apresentam reprodutibilidade. Por fim, a prática demonstrou-se eficiente gerando resultados satisfatórios.
Agradecimentos
Referências
CHOUDHARY, V. R.; SAMANTA, C.; CHOUDHARY T.V. Factorsinfluencingdecompositio nof H2O2 over supportedcatalyst in aqueousmedium. Journal of molecular catalysis.v. 260, n. 1-2, p.115-120, December. 2006.
COSTA, A, R. et al. Decomposição do peróxido de hidrogênio sobre catalisador de manganês.
MATTOS, I, L. et al. Peróxido de hidrogênio: Importância e determinação. Revista Química Nova, v. 26, n 3, 2002.











